Kémiai Nobel-díj 2018
Kandidátusa Fizikai és Matematikai Tudományok, E. Lozovsky.

Osamu Shimomura (Osamu Shimomura) a Tengerbiológiai Laboratórium (Marine Biological Laboratory) a Woods Hole (Massachusetts).


Roger Tsien (Roger Y. Tsien), a University of California, San Diego hozzájárult ahhoz, hogy megértsük a természet a GFP fluoreszcencia.
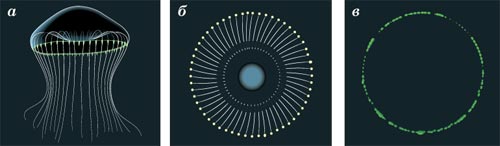
Medúza Aequorea victoria (a) tartózkodik a Csendes-óceán nyugati partjainál Észak-Amerikában. A foszforeszkáló szervek szélén található az „ernyő” (b, c).
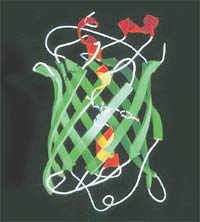
Zöld fluoreszcens fehérje a következőkből áll 238 aminosavból. „Barrel” aminosav lánc minimalizált formájában. Belül a kromofor csoport, amely elnyeli a kék fényt bocsát ki, zöld.
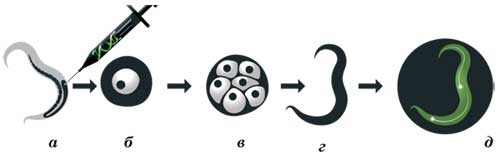
A DNS-technológia, Chalfie beépült egy gént egy zöld fluoreszcens fehérje gén kapcsoló, amely elindítja a munkáját hat receptor neuronok a fonalféreg C. elegáns.
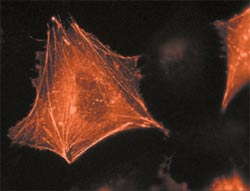
Sejtfehérje aktin megjelöljük egy vörös fluoreszcens fehérje (RFP), úgy néz ki, fluoreszcens mikroszkóp alatt, mint egy elegáns piramis.
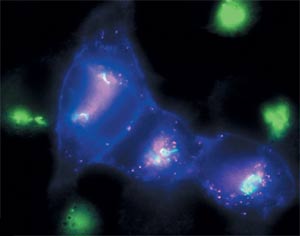
Az újonnan szintetizált a-sejt-receptor-protein Lamp2 kék fénnyel világít, a Golgi-apparátusban - zöld és a régi, régen volt „született” receptor fehérjék ad egy vörös fluoreszcencia.
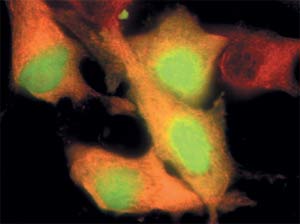
A sejt belsejében az a sejt citoplazmájában háttér zöld fény látható vörös szál fehérje tubulin.
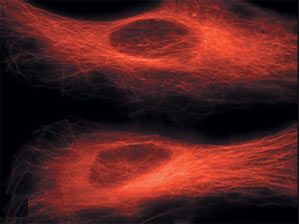
Kecses felhők világít a tubulin fluoreszcens mikroszkóp piros.
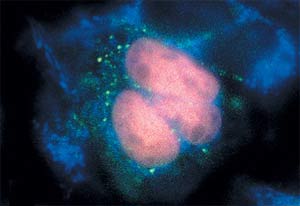
A fehérje szintetizálódik a sejtmagban, izzik piros gyenge zöldes-kék a sejtek fluoreszcenciáját magukat.
Zöld fluoreszcens fehérje (zöld fluoreszcens fehérje, GFP) fedezték fel 1962-ben a szervezet a medúza Aequorea Victoria. Akkor senki sem tudta, hogy miután több évtizedes GFP a medúza és fluoreszcens fehérjék más tengeri állatok fontos eszközzé váltak a biológiai és orvosi kutatás.
És így kezdődött a történet. 1960-ban, a bennszülött japán Osamu Shimomura sikeresen megkezdte a vizsgálatot biolumineszcensz tengeri rákfélék Nagoya Egyetem, meghívást kapott munkát a Franka Dzhonsona labor a Princeton, a neves amerikai egyetemen. A cél a kutatás volt az a kis medúza a nemzetség ekvoreya él a Csendes-óceán északi. Nyugalmi állapotban ez medúza színtelen, de stimuláció a szélét „ernyő” kezd zölden világít. Kezdetben Shimomura izolált ekvorei fluoreszcens fehérje, szinkronizált „aequorin”. Aequorin megvan az a képessége, hogy fényt bocsátanak ki csak a kalcium ionok jelenlétében, és az energiaforrás egy kémiai reakció a coelenterazine oxidáció - kis molekulatömegű anyag, csatolt egy aequorin komplex.
Shimomura és Johnson felhívta a figyelmet arra a tényre, hogy a quorin bocsát ki kék fényt, bár az élő medúzák zölden laboratóriumi körülmények között. Azt találtuk, hogy a sejtekben ekvorei van egy csodálatos fehérje, ha besugárzott kék vagy ultraibolya fény, ez ad egy zöld fény (fluoreszcencia). Ez a fehérje, és ezt követően kapta a nevét GFP. A medúza szervezetben előfordul sugárzásmentesen energia átviteléhez a kék fény GFP quorin molekula közelében található, amely átalakítja a zöld fény.
Végén az 1970-es, Shimomura képes volt megállapítani a természet a kromofór - kémiai, hogy egy csoport a zöld fluoreszcens fehérje, amely elnyeli és fényt bocsát ki. A ragyogás GFP, ellentétben aequorin és más részt vevő fehérjék biolumineszcencia nem társulnak kémiai reakciók: izzik való besugárzás hatására kék vagy UV-fény. Ez az a képesség, hogy fluoreszcencia és képezte az alapját a későbbi használat GFP világító fehérje címkét, amely láthatóvá teheti a folyamatokat élő sejtek.
Fluoreszcens fehérjék tettek egy igazi forradalom, a tanulmány az élő sejtek. Ezek segítségével láthatja, hogy a kísérlet tart a fehérjék szintézisében, mint a neuronális kapcsolatok alakulnak, mint az embrió fejlődik, és még sok más.
SEJTBIOLÓGIAI új megvilágításban
Kémiai PhD Q. Verkhusha, vezetője Laboratórium professzor Anatómiai és strukturális biológia, College of Medicine. Alberta Eynshteyna (New York, USA).
A legnagyobb hozzájárulást fluoreszcens fehérjék, sejtbiológia. Felfedezése előtt a zöld fluoreszcens fehérje, a tudósok képeket készít az elhalt sejteket festettünk mesterséges színezékeket. GFP és modernebb többszínű fehérjék hagyjuk fényképezni egy élő sejt mozgásban (elmozdulás) és a fejlesztés.
Miért csak felfedezése után GFP volt lehetséges, hogy „lássa” hogyan fehérjemolekulák működik az élő sejtek és szövetek a test?
Először is, ellentétben más fluoreszcens címkék, a GFP-szerű fehérjék az izzás nem kell semmilyen kiegészítő anyagokat, továbbá a molekuláris oxigén, így a sejt életben marad, és ép.
Másodszor, ellentétben más színezékek, GFP - egy fehérje molekula, amely kialakul a sejtben a genetikai kódot. A modern géntechnológiai módszerek lehetővé teszik, hogy „varrni” a gén bármely fehérje és egy fluoreszcens fehérje gént, majd hozzáadni ezt a genetikai „kiméra” egy sejtben vagy szervezetben modell. Az ilyen genetikailag módosított sejt elkezd szintetizálása komplex „kiméra” protein, amely proteinszerű molekulát világító.
Harmadszor, a fluoreszcens fehérje molekula elég kicsi, ezért gyakorlatilag nincs hatása a „partner”. Ez azt jelenti, hogy a teljes komplex fehérje szerkezetét funkciója ugyanaz, mint a fehérje önmagában, anélkül fluoreszcens jelölést.
Például, a genetikai enzim után „csatlakozott” a fluoreszcens fehérje ugyanaz marad enzimet, de egy nagyon fontos különbség - válik láthatóvá fluoreszcens mikroszkóp alatt. Most láthatjuk, ahol ez az enzim az élő sejtekben, ahogy mozog az egyik cellából a másikba szerkezet, mint a változó összeget hatása alatt olyan gyógyszerek, stb
Fluoreszcens fehérjék lehetővé teszik, hogy tanulmányozza a lokalizáció fehérjék a sejten belül, vagy egy elég lassú ahhoz, (néhány percen belül) elmozdulás. Hogy tanulmányozza a nagyon gyors (time # 62465; m állásfoglalást száz milliszekundum) mozgását a fehérjék, a modern tudósok mentek tovább, mint a Nobel-díjas, és létrehozott egy fénnyel aktiválható fluoreszcens fehérjéket. Kezdetben az ilyen fehérje vagy nem fluoreszkálnak vagy fluoreszkál egy színben. A besugárzás után, egy rövid impulzus lézer vagy fotoaktiválható fehérje válik fluoreszkáló vagy változtatásokat a fluoreszcencia fény. Befejezése után egy sor képek vezethető a proliferáció a „kiméra” fehérje szerkezetét a lézeres besugárzás régió más részeire a sejt. Használata fotoaktiválható fehérjék kombinálva mnogolazernymi mikroszkópok és a legújabb képfeldolgozási technikák lehetővé teszi, hogy képeket készít sejtek és a sejten belüli struktúrák térbeli felbontással sokkal magasabb (azaz, 15-25 nm), mint a klasszikus optika.
Abban az időben, Mihail Matts a Lukyanov laboratóriumában és Julius Labas az Institute of Ecology and Evolution, Orosz Tudományos Akadémia azt javasolta, hogy az intenzív szín a korallok és a fluoreszkáló ultraibolya társítható jelenlétében GFP-szerű fehérjék. Ha bejelöli ezt merész hipotézis csatlakozott az egész laboratóriumi, és hamarosan klónozott gén az első vörös fluoreszcens fehérje úgynevezett DsRed. Ez az első alkalom, hogy kimutatták, hogy a fluoreszcens fehérjék elterjedt tengeri élőlények. Nyitva Lukyanov csoport okozott tengely tudományos közleményeinek. Eddig a tudósok világszerte klónozott több mint 200 különböző gén fluoreszcens fehérjéket tengeri élőlények. A számos létező genetikai módosítások ezen fehérjék a nagyságrenddel nagyobb.
15 év alatt az aktív kutatás hasznos tulajdonságai GFP-szerű fehérjék már többször megerősítették. A tudósok új formái GFP-szerű fehérjék dalnekrasnoy fluoreszcens spektrumát a régióban, ahol a háttér-fluoreszcenciát saját szövetek és sejtek jellemzően akadályozza a megszerzése jó képek, minimalizálható. A felfedezés a sárga-narancssárga, piros és dalnekrasnyh fehérje válik lehet megfigyelni akár öt „kiméra” fehérje szerkezetek egy sejtben egyidejűleg. Együtt az új úgynevezett két-foton mikroszkópia, lézerfény, amely behatol, hogy a mélysége néhány milliméter, dalnekrasnye fehérjék teszik sejteket, hogy lövések és a sejten belüli struktúrák nem csak a felszínen, hanem a belsejében élő szövet. A kutatók is dolgoznak új fluoreszkáló molekuláris bioszenzor, amely lehetővé teszi, hogy mennyiségileg enzim aktivitását sejtekben, a koncentráció különféle celluláris metabolitok közötti kölcsönhatás intracelluláris fehérjék és még sok más.
Ragyogó fehérjék minden bizonnyal nagy jövő.
Információ www.nobelprize.org Nobel-bizottság