Kémiai kötés delokalizált p, p- és p, p-párosítás (butadién-1, 3; klór-etil)

Home | Rólunk | visszacsatolás
p-kötés lehet lokalizált és delokalizált. Lokalizált ez az úgynevezett kettős kötés, amelyben az elektronsűrűség a p-kötés alá csak két magot összekapcsolódó atomok. Delokalizált kötést jellemző konjugált rendszerek. Ha a molekula két kettős kötést (vagy több) elválasztva egyetlen kötés vagy a szomszédos atomon a kettős kötés, egy p-orbitális, akkor a p-pályák szomszédos atomból átfedhetik egymást képező közös p-elektron rendszert. Ez a rendszer az úgynevezett konjugált.
Kétféle konjugáció: p-p-konjugát és p-p- feszültség-konjugátum. Egy példa a legegyszerűbb p-p-konjugát rendszer egy molekula butadién-1,3. A 1,3-butadién-molekula két p-kötések vannak elválasztva egy S-kötést. Minden szénatom sp2-hibridizáció, és a molekula, sík szerkezetű. A nem hibridizált pz pályák minden szénatom található erre a síkra merőleges ,. E. egymással párhuzamosan. Ez megteremti a feltételeket a kölcsönös átfedés. Átfedő pz pályák képződéséhez vezet egyetlen p-elektron felhő. Ebben az esetben azt mondjuk, hogy p-delokalizációja az elektronok, azaz. E. P-képződő p-konjugátum rendszerben.
Ha van egy kettős kötést olyan atommal, amelynek egy nem-kötő p-orbitális, akkor ez a fajta interfész az úgynevezett p-p. A p-pályák az atom a magányos elektronpár. A legtöbb esetben, a kialakulása p-p-párosítás bevonásával heteroatomot - oxigén-, nitrogén-, halogének, kén. A p-orbitális elektronok reagál p-kapcsolatot alkotnak a p-p-konjugált rendszer. Egy példa az a molekula, divinil-éter:
6. A polarizációja kémiai kötések szerves molekulák. Induktív (I) és a mezomer (M) az elektronikus hatások. Grafikus ábrázolása az elektronikus hatások
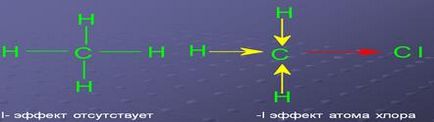
Polaritás kommunikációs opredelyaetsyaelektrootritsatelnostyu atomok. kötés képzésére. Minél nagyobb a különbség a elektronegativitása kötésű atomjai, a poláris kötés. Például, a kapcsolat polaritást.
Polarizálhatóságot kommunikációs- jelenség összefüggésben nőtt a reaktivitás kommunikáció miatt könnyebb a törzs.
Polarizálhatóságának kommunikáció függ:
a) a sugarak a alkotó atomok ezt a kapcsolatot. Minél nagyobb a sugara az atom, a több „laza” a elektron héj az atom, és annál könnyebb deformálódik. Például, a kommunikációs I-I könnyebben polarizálható, mint egy kötés Cl-Cl;
b) a electronegativities az alkotó atomok a kötést. Minél nagyobb a elektronegativitása az atom, a kompaktabb ez elektron héj és a nehezebb és deformálódik, hogy;
c) a természet az elektronok alkotó ezt a kapcsolatot.
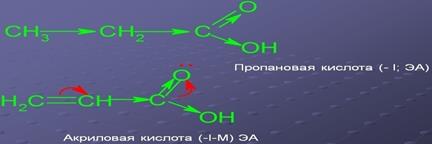
Kettős vagy hármas kötéseket kialakítva π-elektronok polarizált lényegesen könnyebb, mint egyszeres kötéseket kialakítva hibrid pályák.
Polarizálhatóságot kommunikáció nem függ a polaritás
Például, a kettős kötés a molekulában az etilén (CH 2 = CH 2), nem-poláris, de ez könnyen polarizálható, és a kötés C- Cl jóval polárisabb, mint a kötés a C-I, de kevésbé könnyen polarizálható.
Így a polaritás és polarizálhatóságának kötvények - fontos tényező, hogy figyelembe kell venni, ha figyelembe vesszük a problémát, a kölcsönös hatása tartalmaz.