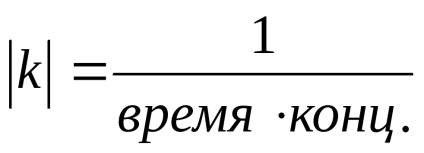kémiai kinetika
A kémiai reakció sebessége számú elemi események a fellépő kémiai reakciókkal egységnyi idő egységnyi térfogatú (a homogén reakció), vagy egy egységnyi területen (a heterogén reakciók).
A kémiai reakció sebessége változik a reagáló anyagok koncentrációit időegység. Megkülönböztetni átlagsebesség
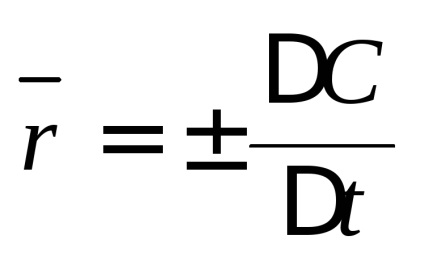
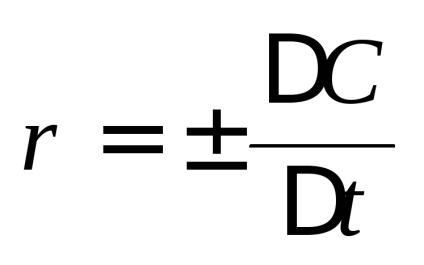
Az egyik a kihívásokat kémiai kinetika által, hogy meghatározza az összetétele a reakcióelegy (azaz, a reagáló anyagok koncentrációit) bármikor, amely szükséges, hogy ismerjük a függését reakciósebesség a koncentrációt. Általánosságban, minél nagyobb a koncentrációja a reaktánsok, annál nagyobb a mértéke egy kémiai reakció. A kémiai kinetika alapul tömeghatás törvénye:
A kémiai reakció sebessége
A K együttható az arányossági tényező a kémiai reakció sebességét. A sebességi állandó számszerűen egyenlő a reakció sebességét minden koncentrációban a reagensek egyenlő 1 mol / l.
Függése a reakciósebesség a reaktánsok koncentrációja kísérletileg határozzuk meg, és az úgynevezett kinetikus egyenlet a kémiai reakció. Nyilvánvaló, hogy annak érdekében, hogy rögzítse a kinetikus egyenlet, meg kell kísérletileg nagyságának meghatározásához a sebességállandók és kitevők koncentrációban a reagensek. A kitevő minden egyes koncentrációjánál a reagensek kémiai reakció kinetikai egyenlettel etochastny reakció érdekében, ezt a komponenst. A összege a kitevőket a kinetikus egyenlet a kémiai reakció (n1 + n2 +.) Képviseli a reakció sorrendben soboyobschy. Hangsúlyozni kell, hogy a sorrendben a reakció lefutását a kísérleti adatokat csak, és nem kapcsolódik a sztöchiometrikus együtthatók a reagensek a reakció egyenletben. A sztöchiometrikus reakció egyenletet az egyenlet a anyagmérleg és semmiképpen sem, hogy meghatározza a természete ennek a reakcióidő.
Basic (egyszerű) nevű reakció zajlik egy lépésben. Ezeket általában sorolják molekuláris - a részecskék száma, amelyek szerint a kísérletesen meghatározott reakció mechanizmusa az elemi cselekmény kémiai kölcsönhatás.
Monomolekuláris - reakciók, amelyekben van egy kémiai átalakítás egyik molekula (izomerizáció, disszociáció, stb ...):
I2I • + I •
Bimolekuláris - reakció elemi aktus, amelyet akkor végezzük, amikor egy ütközés két részecskék (azonos vagy különböző):
Trimolekuiáris - reakció elemi aktus, amely akkor történik, amikor egy ütközés három részecskék:
Reakciók Molecular több mint három ismeretlen.
Az elemi reakciók végzett hasonló koncentrációban a kiindulási anyagok, valamint a nagyságrendekkel a molekuláris reakció egybeesik. Azonban nem jól meghatározott kapcsolat a fogalmak a molekuláris és a reakció érdekében, nem létezik, mert a sorrendben a reakció jellemzi a kinetikus egyenlet a reakció, és a molekuláris - reakció mechanizmusára.
Ha C1 = C2 = ... = 1, k = r. azaz sebességi állandó a reakció sebességét ezen a hőmérsékleten, és minden koncentrációnál az egyes reagensek. Speed előre és hátra reakciók egyensúlyi, és az arány pryamoyk1 állandók és obratnoyk 1, amelyen a sebesség megfelel az egyensúlyi állandó
A harmadik fontos jellemzője az a kinetikus sorrendben a reakció. Ez egy összefoglaló a mértékét a kísérleti egyenlet, amely meghatározza a függőség a sebesség a reakciópartner koncentrációját. Általánosságban, az eljárás nem esik egybe a molekuláris, mert nem tükrözi a sztöchiometriai arányt, amelynél a teljes kölcsönhatás lép (ez határozza meg a molekuláris reakció), és a tényleges mechanizmus a folyamat meghatározott feltételek mellett. Ezért, ellentétben a molekuláris, amely mindig által kifejezett egy egész szám, és lehet nullával egyenlő, az eljárás lehet kifejezni frakciók vagy nullára. Eljárás fenti második gyakorlatilag nem fordul elő, mivel egyidejű ütközés három vagy több részecske nem valószínű.
Tekintsük a jellemzői a reakciókat az 1. és 2. sorrendben.
A reakciókat az 1. sorrendben. Ha egy állandó térfogatú rendszert, a reakció sebessége határozza meg az egyenlet
Integrálását követően az expressziós (7) adott időben a 0 és TP koncentrációban otC0 DOC kapjunk
vagy ha miután x jelöli az anyag mennyiségét reagált momentut, toS0 vagy -C = x
Találunk egy fél élet, vagyis idő, amely alatt a kiindulási anyagot reagáltatjuk, pontosan a fele reakciót t1 / 2 az elsőrendű.
(8), amely:
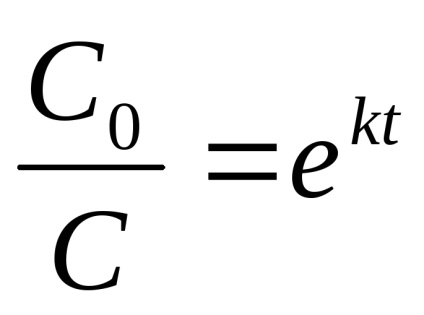
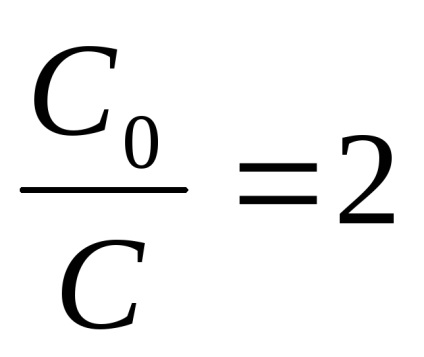
A fentiekből következik, hogy nem függ a választott és a koncentráció egységek határoztuk csak időzítés egységek a reakció az 1. rendű sebességi állandó számérték

Reakció 2. sorrendben. A legegyszerűbb esetben,
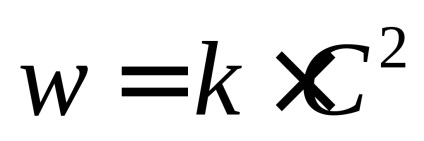
vagy
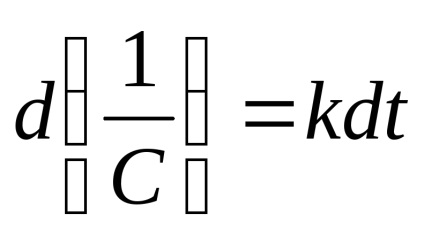
A felezési idő megfelelő
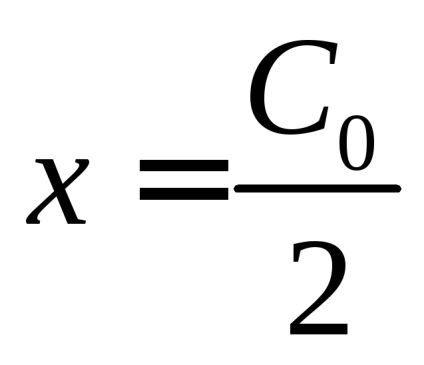
Tól (14) következik, hogy a számérték a másodrendű reakció sebességi állandókat határoztuk meg a választott koncentráció egységek