Hogyan lehet megoldani s2 kémia - tippek és trükkök
Cél C2 EGE vegyszer egy leírását a kémiai kísérlet, ahol a szükségességét, hogy a reakció a 4. egyenlet. A statisztikák szerint, ez az egyik legnehezebb feladat, nagyon alacsony százalékban átadása megbirkózni vele. Az alábbi ajánlások a döntés a feladat C2.
A - Az első, a döntés joga a feladat C2 vizsga kémiából kell helyesen azonosítani a tevékenységek, amelyek ki vannak téve az anyag (szűrés, bepárlás, égő, égetés, szinterezés, fúzió). Meg kell érteni, ahol egy anyag fizikai jelenség, és ahol - a kémiai reakcióban. A leggyakrabban használt anyagok az alábbi lépéseket.
Szűrés - módszer elválasztására heterogén keverékek szűrők használatával - porózus anyagok, áteresztő folyadék vagy gáz, de a késés szilárd. A szétválasztás tartalmazó keverékek folyékony fázis a szűrőn szilárd, a szűrletet áthalad a szűrőn.
Bepárlás - a folyamat koncentráló megoldások az oldószer elpárologtatásával. Előfordul, hogy a bepárlást addig folytatjuk, amíg a telített oldat, az ezt követő kristályosítással ezeknek a szilárd kristályos formában, vagy addig, amíg a teljes az oldószer elpárologtatása, hogy megkapjuk a feloldott anyag tiszta formában.
A kalcinálás - fűtés az anyag módosításához a kémiai összetétele. A kalcinálás végezhetjük levegő és inert gáz atmoszférában. Levegőn való kalcinálás kristályos hidrátok elveszítik kristályvíz, például CuSO4 ∙ 5H2 O → CuSO 4 + 5H2 O
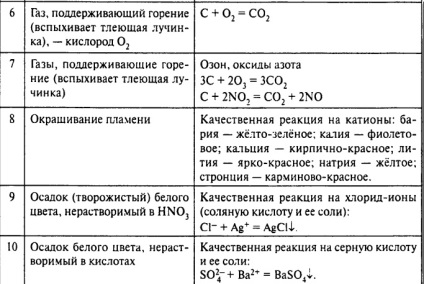
Termikusan instabil anyagok lebomlanak:
Cu (OH) 2 → CuO + H2 O; CaCO3 → CaO + CO2
Szinterelés fúziója - a fűtés két vagy több szilárd reagensek, ami azok kölcsönhatása. Ha reagensek ellenálló oxidálószerekkel, a szinterelési végezhetjük a levegőben:
Al2 O3 + Na 2CO 3 → 2NaAlO2 + CO2
Ha a reagensek egyike, vagy reakciótermék lehet levegő oxidálható termékeket, az eljárást úgy hajtjuk végre inert atmoszférában, mint például a Cu + CuO → CU2O
Anyagok labilis komponensek a levegő oxidált kalcinálás során, reagálnak levegővel komponensek:
2SU + O2 → 2CuO;
4Fe (OH) 2 + O2 → 2Fe2 O3 + 4H2O
A kalcinálás - hőkezelési eljárást, ami a belső égésű anyagokat.
Másodszor, a tudás a jellegzetessége anyagok (szín, szag, halmazállapotban) fogja szolgálni a célzást, vagy érvényesítési tevékenységek. Az alábbiakban a legjellemzőbb tulajdonságait gázok, oldatok, szilárd anyagok.
Jelei gázok:
Színtelen, szagtalan H2. N2. O2. CO2. CO (méreg), NO (méreg), inert gázok. Minden rosszul oldódik vízben.
Színtelen Szag: HF, HCI, HBr, HI, SO 2 (éles szagok), NH3 (ammónia) -jó oldódik vízben és mérgező, PH3 (fokhagyma), H2 S (rothadt tojás) - mérsékelten oldódik vízben, mérgező.
Színes megoldások:
Sárga: kromát, például K2 CrO4. oldatai vas- (III), például FeCl3.
Narancssárga: brómos vizet, cpirtovye és az alkohol-vizes oldatok a jód (koncentrációtól függően a sárga és a barna). dikromátok, például K2 Cr2 O7
Zöld: Hydroxocomplexes króm (III), például, K3 [Cr (OH) 6], nikkel-só (II), például NiSO4. manganátok, például K2 MnO4
Kék: sókat réz (II), például SuSO4
A rózsaszín lila: permanganát, például KMnO4
Zöldről kékre: sói króm (III), például CrCl3
Festett csapadék:
Fekete, fekete és barna: A szulfidok réz, ezüst, vas, ólom,
Zöld: Cr (OH) 3 - kék-zöld, Fe (OH) 2 - piszkos zöld, megbarnul levegőben
Egyéb színes anyagok:
Sárga kén, arany, kromát
Narancssárga: oksid réz (I) - CU2O, dikromátok
A szürke színű, fémes csillogás: grafit, kristályos szilícium, kristályos jódot (szublimálással - lila gőzök), a legtöbb fém.
Harmadszor, amikor a döntés feladatok C2 kémiája az egyértelműség érdekében, ajánlható, hogy a program vagy szekvenciáját transzformációk eredetű anyagok.
Végül, annak érdekében, hogy megoldja ezeket a problémákat, szükség van pontosan tudni, hogy a tulajdonságai fémek, nem fémek és vegyületeik: oxidok, hidroxidok, sók. Meg kell ismételni a tulajdonságait salétromsav és kénsav, permanganát és kálium-dikromát, a redox tulajdonságait a különböző vegyületek, elektrolízis olvadékok és megoldások különböző anyagok, a bomlási reakció a vegyületek különböző osztályainak az amfoter sói hidrolízis.