Hidrogén-klorid és sósav
A halogenidek különösen fontos kloridot.
A laboratóriumban, a hidrogén-kloridot úgy állíthatjuk elő melegítésével szilárd nátrium-klorid tömény kénsavval. Ehhez cső kristályos nátrium-kloridot adunk hozzá, tömény kénsavat. Cap az injekciós üveg dugót egy gázelvezető cső, amelynek végén helyeztünk egy üvegcsébe vizet.
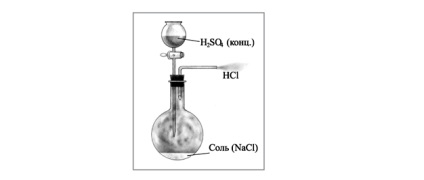
A reakció jól megy, és melegítés nélkül, de lehet enyhén melegítjük, hidrogén-klorid intenzív kiválasztását, ha megfelelő edénybe a reakcióelegyet. Mivel a nagy oldhatósága hidrogén-klorid a víz is szükséges, hogy tartsa be a biztonsági óvintézkedéseket. Bejutásának megakadályozásáról hidrogén-klorid a levegőcső a vízzel szükséges, hogy fedezze a gyapot enyhén benedvesített.
Mivel a nagy oldhatósága hidrogén-klorid-gázt kivezető csőnek nem kell meríteni vízzel. Ellenkező esetben a víz lehet levonni a csőbe, ahol a tömény kénsav.
Az iparban, hidrogén-klorid szintetikus úton állítják elő, közvetlen kapcsolatban a hidrogén-klorid. Egy másik érdekes kölcsönhatás mechanizmusa klór hidrogénnel. Hatása alatt erős fény bekövetkezik apoláros szünetet kovalens kötések a molekulában a klór. Ennek eredményeként, a klór atomok vannak kialakítva egyetlen páratlan elektron (klór gyökök). Ezek nagyon aktív és reagál a hidrogén molekula. Molekula képződött hidrogén-klorid és hidrogén-atomokat páratlan elektront (hidrogénatom). Ezek viszont, hatnak a klór-molekula, ezáltal egy molekula hidrogén-kloridot és klór-gyök. Az ilyen reakciókat nevezzük lánc. Lánc mechanizmus égési reakciók fordulnak elő, robbanások.
Hidrogén-klorid - színtelen gáz kissé nehezebb, mint a levegő, egy éles szag, füst nedves levegőn.

Hidrogén-klorid az egyik leginkább vízoldékony gáz halmazállapotú anyagok. 1 liter vízben szobahőmérsékleten feloldható, maximum 500 l hidrogén-klorid.
A hidrogén-klorid oldatot vizes sósavval hívás (sósav) sav. A fő alkalmazási hidrogén-klorid - megszerzése sósav.
Koncentrált sósavat - színtelen oldatot füst nedves levegőn egy éles szaga hidrogén-klorid. Ez lehetséges 40% sósavoldattal.
Sósav számos tulajdonságok jellemző a legtöbb savak. Az ilyen tulajdonságok közé tartoznak színváltozás mutatók (lakmusz, metilnarancs) piros, valamint a kölcsönhatás fémek, állt a sorban tevékenység hidrogénatom, az alapvető és amfoter oxidok, bázisokkal képzett sókat, a gyenge savakkal.
HCl + NaOH → NaCl + H2 O
Ezekben a reakciókban a kapott hidroklorid-sót - kloridok és egyéb termékek.
Egy speciális tulajdonsága, sósav - a reakció ezüst-nitrát-oldattal.

Ezzel a reakciót, sósavat lehet különböztetni az egyéb savak. Ahhoz, hogy egy kis mennyiségű sósavat in vitro dagály kis ezüst-nitrát-oldattal. Megfigyelhetjük a megjelenése fehér caseous ezüst-klorid csapadékot, amely nem oldódik a salétromsav. HCl + AgNO3 → AgCl ↓ + HNO3. Sói sósavat nevezzük kloridok. Ezek a vízben oldható, kivéve az ezüst-klorid, és ólom-klorid (II).
Ha ehhez hozzáadjuk a nátrium-klorid, ezüst-nitrát, az őszi az azonos fehér túrós csapadék: NaCl + AgNO3 → AgCl ↓ + NaNO3. Ezüst-nitrát (vagy ezüst-nitrát) szolgál reagensként sósav és ezek sói. Ez a reakció az úgynevezett kvalitatív reakciót. Ezzel a reakció kvalitatív felismerik sósav és ezek sói.
Sósav használják különböző területeken a nemzeti gazdaság.

Számos acélt, amikor tölt maratás bevonása előtt acéltermékek védő fémréteget (ón, nikkelezés, krómozás). Mielőtt ezeket a folyamatokat kell távolítani az oxidfilm a felületről a termék. Hátránya ennek az eljárásnak az, hogy a sav reagál nemcsak vas-oxid, hanem a fém. Annak elkerülése érdekében, reakciója a sav egy fém savas hozzáadott speciális anyagok - inhibitorok, lelassítják a nem kívánt reakció.
Sósavat gyártásához használt gyógyszerek, festékek, peszticidek, műanyagok és más polimerek, és így a klór a laboratóriumi és bizonyos kloridok.
A vizuális tervezés felhasznált források: