Formula élelmiszer-só in Chemistry
A definíció és képlet étkezési só
Élelmiszer (nátrium) sóját - a nátrium só sósav. Rendes körülmények képvisel fehér kristályok (ábra. 1), slabogigroskopichnye, de ez azok tulajdonságait drámaian megnövekedett jelenlétében a természetes szennyeződéseket, mint például a magnézium-sók
Megolvad és forr bomlás nélkül. Mérsékelten oldódik a vízben (nem hidrolizált), az oldhatóság nem függ a hőmérséklettől, de nagymértékben csökken a sósav jelenlétében, nátrium-hidroxid, fém-kloridok. Folyékony ammóniában oldunk. Ez azt mutatja, hiányosságok csökkentése tulajdonságait.

Ábra. 1. Közös sót. Megjelenés.
Kémiai képlet étkezési só
Kémiai képlet étkezési só nátrium-klorid. Ez azt mutatja, hogy a készítmény a molekula tartalmaz egy nátrium-atom (Ar = 23 amu) és egy klóratom (Ar = 35,5 amu). Szerint a kémiai képlet számított molekulatömege a étkezési só:
Mr (NaCl) = Ar (Na) + Ar (Cl);
Mr (NaCl) = 35,5 + 23 = 58,5
Grafikus (szerkezeti) képletű étkezési só
Structure (grafikus) képletű étkezési só sokkal jobban használható. Ez azt mutatja, hogy az atomok vannak csatlakoztatva egymáshoz a molekulán belül:
ionos képletű
Nátrium-klorid - az átlagos hidrokioridsó lennie disszociációra ionokra vizes oldatban az alábbi egyenlet szerint:
NaCl ↔ Na + + Cl -
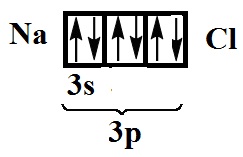
E általános képletű
Oktatási étkezési só molekulában megy végbe a kialakulását egy teljes elektron pár és a párosítatlan elektronok nátrium-klorid (egy-egy atom):
Példák problémák megoldása
Égése közben 7 g szerves anyagot kapunk 11,2 l (STP) a CO2 és 9 g H2 O. A relatív sűrűsége az anyag oxigén 1.313. Find molekuláris képlete az anyag.
Felvázolt égési reakciója szerves vegyületek, amelyek megadott számú szénatomot tartalmazó, hidrogén és oxigén az «X», «y» és «Z», rendre:
Tömegének meghatározásához az elemek alkotják az anyag. Az értékek a relatív atomi tömegeket venni a periódusos D. Mengyelejev, egész számra kerekítve: Ar (C) = 12 amu Ar (H) = 1 amu Ar (O) = 16 amu
Kiszámítjuk a moláris tömege a szén-dioxid és víz. Mint ismeretes, a moláris tömege a molekula az összege a relatív atomi tömegek a tartalmaznak a molekulában (M = úr):
M (CO2) = Ar (C) + 2 × Ar (O) = 12+ 2 × 16 = 12 + 32 = 44 g / mol;
M (H2O) = 2 × Ar (H) + Ar (O) = 2 × 1 + 16 = 2 + 16 = 18 g / mol
m (C) = [11,2 / 22,4] × 6 = 44 g;
m (H) = [2 × 9/18] × 1 = 1 g
Definiáljuk, mint egy kémiai vegyület a képletű Cx Hy:
x: y = m (C) / Ar (C). m (H) / Ar (H);
Ezért legegyszerűbb képletű CH2 vegyület moláris tömege 14 g / mol [M (CH 2) = Ar (C) + 2 × Ar (H) = 12 × 2 + 1 = 14 g / mol].
Moláris tömeg szerves anyag lehet meghatározni a sűrűsége tekintetében oxigén:
Msubstance = 32 × 1,313 = 42 g / mol
Ahhoz, hogy megtalálja a valódi képletű megtalálják az arány a szerves vegyület kapott móltömeg:
Msubstance / M (CH 2) = 42/14 = 3
Ezért az indexek a szén- és hidrogénatomok kell három-szor magasabb, azaz a anyagok képlet lesz formájában C3 H6.