Fehérje szerkezet - studopediya
Fehérjéket. A szerkezet a fehérjék. Tulajdonságok fehérjék.
Fehérje - szekvenciát egymáshoz kapcsolt aminosavak peptidkötésekkel.
Könnyen elképzelhető, hogy a számos aminosav eltérhet legalább két bármeddig értéket. Biokémiai megállapodtak feltételezni, hogy ha a szám nem haladja meg a 10 aminosavból, a vegyület az úgynevezett peptid; Ha 10 vagy több aminosavat - a polipeptid. Képes polipeptidek spontán módon és megtartása bizonyos térszerkezetet, amely az úgynevezett konformáció, a továbbiakban fehérjék. Stabilizálása ilyen szerkezet csak akkor lehetséges, ha a polipeptidek határozott hosszúságú (40 aminosav), azonban a fehérjék általában úgy polipeptidek, amelyek molekulatömege nagyobb, mint 5000 Da. (1Yes egyenlő 1/12 a szénizotóp). Csak azáltal, hogy egy bizonyos térszerkezet (natív szerkezet), fehérje feladatai elvégzésére.
A fehérje méretének mérhető dalton (molekulatömeg), gyakrabban miatt viszonylag nagy értéket egy molekulában származó egységek - kilodalton (kDa). Élesztő fehérjék, átlagosan, álló 466 aminosavból, és a molekulatömege 53 kDa. A legnagyobb a jelenleg ismert fehérje - Titina - egy komponense izom szarkomer; molekulatömege különböző izoformái között változhat 3000-3700 kDa, ez áll a 38 138 aminosavból (humán izom Solius).
A háromdimenziós szerkezet egy fehérje során képződött összecsukható (az angol összecsukható -. «Folding"). A háromdimenziós szerkezetet kölcsönhatásából képződik struktúrák alacsonyabb szinteken. Négy szint van a fehérje szerkezetek:
Az elsődleges szerkezet - a szekvencia az aminosavak a polipeptid-láncban.
Másodlagos szerkezet - ez a tér kihasználtsága az egyes részeinek a polipeptid lánc. A következők a leggyakoribb típusú fehérje másodlagos szerkezetének:
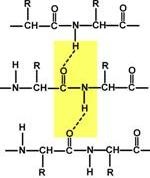
# 945; helix - szoros tekercs körül a hosszanti tengelye mentén a molekula, az egyik felbukkan 3,6 aminosavat, és a spirális emelkedési 0,54 nm (egy aminosav van, hogy 0,15 nm), hélix stabilizált hidrogénkötések között H és O peptid csoportokat el egymástól egy 4 aminosavmaradék. Spirál épített kizárólag egyféle sztereoizomer aminosavak (L). Bár ez lehet mind balkezes és pravozakruchennoy fehérjék uralkodik pravozakruchennaya. Spirál megzavarják a elektrosztatikus kölcsönhatások a glutaminsav, lizin, arginin. Közel helyezzük egymáshoz maradékok aszparagin, szerin, treonin és leucin szterikusan gátolhatják a kialakulását egy spirál, prolin maradékok okoz hajlítási lánc és ugyanakkor megzavarhatja a szerkezet # 945; spirál.
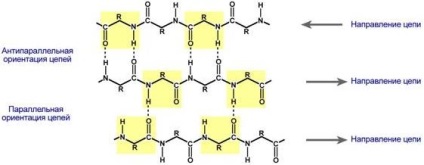
# 946; -skladchatye rétegek - több cikk-cakk polipeptid lánc, amelyben a hidrogén kötések között vannak kialakítva viszonylag távol egymástól (0,347 nm aminosaván) az elsődleges szerkezet vagy aminosavak különböző fehérje láncok és nem szorosan egymás mellett elhelyezkedő, ahogy az a # 945; spirál. Ezeket a láncokat jellemzően N-irányított végek ellenkező irányban (antiparalel orientációban). az oktatás # 946; -skladchatyh rétegek kis méret fontos aminosav oldalláncokon, általában uralják glicin és alanin.
Fektetése fehérje formájában # 945; spirál
Fektetése fehérje formájában # 946; -skladchatogo réteget
Rendezetlen Structures - egy rendezetlen elrendezése a fehérje lánc térben.
A térbeli szerkezet egyes fehérje egyéni és meghatározzuk az elsődleges szerkezete által. Azonban, összehasonlítva a különböző konfigurációi szerkezetének és funkcióinak fehérjék feltárta, hogy ezek hasonló kombinációi másodlagos szerkezeti elemeket. Az ilyen eljárás kialakítására specifikus másodlagos szerkezeteket a nevezett fehérjék supervtorichnoy szerkezetét. Supervtorichnaya struktúra alakult miatt mezhradikalnyh kölcsönhatások.
Bizonyos kombinációi jellemző # 945; hélix és # 946; -structures gyakran nevezik „strukturális motívumok”. Van egy konkrét név: "# 945; Hélix-povorot- # 945; spirál", „szerkezet # 945; / # 946; -bochonka "" leucin-cipzár "" cink-ujj „et al.
Tercier szerkezet - egy eljárás a forgalomba az egész térben, a polipeptid-lánc. együtt # 945; spirál, # 946; -skladchatymi supervtorichnymi rétegek és szerkezetek a harmadlagos szerkezet talált rendezetlen konformációt, amely akár egy jelentős része a molekula.
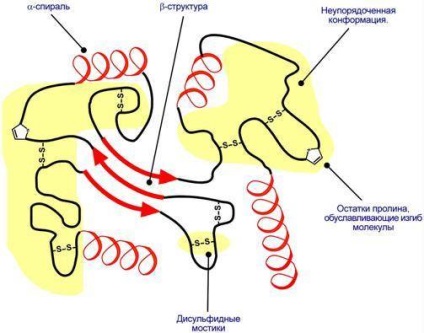
Sematikus ábrázolása fehérje feltekeredés harmadlagos szerkezete.
A negyedleges szerkezet fordul elő fehérjék amelyek több polipeptid-láncok (alegységei vagy monomerek promoterok), ezek egyesítésével subdinits tercier struktúrákat. Például, a hemoglobin molekula áll 4 alegységből. Kvaterner szerkezet kialakulásának a szupramolekuláris - multienzim komplexek, amelyek az álló néhány molekulája az enzimek és koenzimek (piruvát-dehidrogenáz) és izoenzimek (LDH - laktát-dehidrogenáz, kreatin-foszfokináz -KFK).
Szóval Térbeli szerkezete nem függ a hossza a polipeptid-lánc, és a szekvencia az aminosav specifikus minden egyes fehérje, hanem az oldalán a gyökök aminosavának megfelelő jellemző. Térbeli háromdimenziós szerkezetének vagy konformációjának a fehérje makromolekulák alkotnak elsősorban hidrogénkötéseket, hidrofób kölcsönhatások között nem poláros aminosav-oldal-csoportot, közötti ionos kölcsönhatás ellentétesen töltött oldallánc csoportokkal aminosavmaradékok. Hidrogénkötések fontos szerepet játszanak a kialakulása és fenntartása a térszerkezet a fehérje molekula. Ami a hidrofób kölcsönhatások, erednek érintkezése a nem-poláros gyökök, nem tudja, hogy megtörjük a hidrogénkötés vízmolekulák közötti, amely elmozdul a felszínen a fehérje gömböcske. Mivel a protein szintézist apoláros kémiai csoportot a gömböcskék összegyűjtjük, és a poláris kényszerült a felszínén. Így, a fehérje molekula lehet semleges, pozitív töltésű vagy negatívan függően a pH és az oldószer ionos csoportokat a fehérje. Ezen túlmenően, a konformációja fehérjék által fenntartott kovalens kötések S-S, kialakítva a két ciszteinmaradék. Ennek eredményeként, a kialakulását natív protein szerkezete sok atomok távoli telephelyek a polipeptid láncok jönnek össze, és, hatva egymásra, szerezhet új tulajdonságok hiányzik az egyes aminosavakból vagy kis polipeptidek.
Fontos megérteni, hogy az összecsukható - a fehérjék térszerkezetének kialakulását (és egyéb Biomacromolecules) a becsukott konformáció a „natív” formában - fizikai-kémiai folyamat, amelyben a fehérjéket természetes „élőhely” (megoldás citoplazmában vagy membrán) szert egyedülálló nekik térbeli hajtogatási és funkciót.
A sejtek számos katalitikusan inaktív fehérjék, amelyek mégis nagyban hozzájárulnak a kialakulásához térszerkezetére fehérjék. Ez az úgynevezett gardedámok. Chaperonok segítse a helyes kialakulását a három-dimenziós fehérje konformáció kialakításával reverzibilis nem kovalens komplexek létrehozása a részben hajtogatott polipeptid-lánc képződik egyidejűleg gátló hibás csatlakoztatás képződéséhez vezető funkcionálisan inaktív fehérjét struktúrák. A listát a funkciók sajátos chaperonok magukban foglalják a védelmet megolvadt (részben összehajtogatott) gömböcskéket aggregációs valamint közlekedési újonnan szintetizált fehérjék különböző helyekre, sejtek. Chaperones előnyösen hő-sokk fehérjék, melyek szintézisét növeli élesen hőmérsékleti stressz expozíció, így ők is nevezik HSP (hősokkfehérjék). Család fehérjék megtalálhatók a mikrobiális, növényi és állati sejtek. Osztályozás chaperonok alapján molekulatömegű, ami változik 10-90 kDa. Ezek a fehérjék segítő folyamatok háromdimenziós fehérjék szerkezete. Chaperones tartsa újonnan szintetizált polipeptid-lánc a hajtogatás nélküli állapotban, nem teszi lehetővé, hogy hajtsa más, mint a natív formája, és biztosítja a feltételeket az egyetlen helyes, a natív fehérje szerkezetét.
A hajtogatás a fehérjemolekula elutasítja bizonyos konformációkban lépésben olvadt gömböcske. Lebomlása ilyen molekulák kezdeményezi fehérje ubiquitin. protein lebomlást az ubiquitin utat tartalmaz két alapvető lépéseket: 1) kovalens kapcsolása ubiquitin, hogy a tárgy lebomlását a fehérje révén lizin-maradék, a jelenléte egy ilyen címke fehérje az elsődleges szortírozó jel útmutató képződött konjugátumok a proteaszóma, a legtöbb esetben, hogy egy fehérje kapcsolódik több molekula ubiquitin, hogy szervezett formában gyöngyfüzér.; 2) A protein hidrolízisének proteoszóma (elsődleges funkciója a proteaszóma - a proteolitikus degradációját károsodott fehérjék és szükségtelen, hogy a rövid peptidek). Ubiquitin méltán nevezik a „Halálra jelölve” fehérje.
fehérje-domén - az elem a harmadlagos szerkezetét a fehérje, amely kellően stabil és független a fehérje alépítmény amelynek összecsukható függetlenül történik a többi alkatrész. A domén struktúra jellemzően magában foglalja a több elemeit másodlagos szerkezetét. Hasonló szerkezetű domének találhatók nem csak a kapcsolódó fehérjék (például hemoglobin különböző állatok), hanem teljesen más fehérjék. Egy adott fehérje lehet több domainnel, ezek a helyek lehetnek különböző funkciók egy és ugyanazon fehérjét. Domain szerkezet egyes enzimek és az összes immunglobulinok. Fehérjék hosszú polipeptid lánc (több mint 200 aminosavat) gyakran létre doménstruktúrával.