Etil-butil-étert - hivatkozási vegyész 21
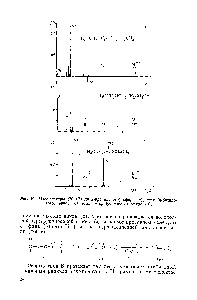
Ábra. 10. Tömegspektrum (70 eV) di (-propilovogo) észter (a) etil (butil) észter (b), etil (AGORA-butil) észter (a).
Cseppfolyós C4-frakció van keverve tartalmazó vizes elegyet etil-celloszolv és egy emulgeálószert, egy keverőben 1, n kapott emulziót engedjük át az akkumulátor gidratatorov 2 térsebességgel 1,5-2 órán át. Ilyen körülmények között a konverziós izobutén 92%, a hozam terc-butil alkohol olefin konverzió - 98%. Gyakorlatilag az egyetlen mellékterméket ebben a lépésben az etil-Thr / n-butil-éter etilén-glikol. reakcióban alakul ki az izobutilén etil-cellosolvban. Ebben a szakaszban a kiszáradás teljesen elbomlik éterrel kiindulási anyagok. [C.232]
Ez a vegyület nem rendelkezik előnyökkel a jelen-alkilezőszerként képest az F-butil-éter / i-toluolszulfonsav. Néhány észterei metánszulfonsav és szénhidrátok ismertetett Helferich és munkatársai [676]. [C.117]
Butén-1-aktivitás által kissé eltér a butén-2, és minden túl vtor.butilovye savakkal kezelve a megfelelő savakkal képzett észtereik. de alacsonyabb hozamot. Character ecetsav Amellett, hogy a két normál butén, amely azonos hőmérsékleten sok közös. A 50 ° C-on a hozam vtor.butilatsetata folyamatosan emelkedik anélkül, hogy elérné a maximális 48 órán belül. 97 ° C-on, a reakció efiroobrazovaniya első jön gyorsan, majd lelassul. Hozam vtor.butilatse-acetát elérte a 48% -ot butén-1 8 órán át. és 62% butén-2, 19 órán át. és ez így marad legalább 24 órán keresztül. [C.13]
Használhatatlan marad keverve trikrezil-foszfát, például glitsidiloleat, butilkarbitolritsinoleat, etilglikolritsinoleat, etil-butil-észter a szójaolaj. gidroabietilovy alkohol és más lágyítószerek. amelyeket csak a márkanevek. [C.446]
Tetrahlorftalaty kevésbé alkalmas előállítására paszták vinilita VYNV2, mint erre a célra alkalmazott, di- (etil-hexil) ftalát. Pépet képezünk. a viszkozitás, amely megfelelhet egy pasztát tartalmazó 100% metilcellulóz-ftalát, szükséges bevezetni 160%, illetve 174% -a butil-etil-butil-észter, tetraklórftálsav. [C.572]
További 6% akrilátok (előnyösen a diszperzió formájában) alkalmazunk a befejező bőr. Akrilát diszperzió növekedése rugalmasságát igénypont kötési szilárdsága a bevonat rétegnek a szubsztrátumhoz. Amikor ez a metil-észter. így egy lágy filmet. elsősorban a bőr felé forditott, és butil-éter - kezelésére súlyos bőr. A elterjedése mesterséges bőr (naprpmer, a márka a vállalat Korfu Wee ROP1) elkerülhetetlenül növeli a fogyasztását akrilátok. [C.160]
De ebben az esetben képződött nekiütközik bushyaovya-észterben 6% mennyiségének a kapott acetonos. T / a-butil-étert nem indentifitsirovan a terméket a reakció a gázfázisban. [C.319]
Burd és munkatársai [10] pont ebben az összefüggésben, hogy általában előnyös, ha a reakcióelegyhez egy magas forráspontú rasgvori-Tel, például a benzol, a toluol vagy a butil-éter. és kiindulási vezetni be az oldószert - etil-észter. A legkényelmesebb oldószerként benzolt, mert a viszonylag alacsony forráspontja (80 °) lehetővé teszi, hogy eljárást végző a leginkább enyhe körülmények között. [C.401]
Összefoglalva azt mondhatjuk, hogy a gazdaság az elszappanosítási alatt IFC szintetikusan előnyös abban az esetben gátolt észterek. Tehát szükség van, hogy a rendszer használatához szilárd kálium-hidroxid / toluol, koronaéterek és kriptandok katalizátorként. Továbbá, a hidrolízis sebessége az egyszerű észterek karbonsavak tömény nátrium-hidroxid vizes oldatot hidrofil jelentősen magasabb karboxilátok. Jó katalizátorok a kvaterner ammóniumsók. különösen BU4NHSO4 és néhány anionos és nemionos felületaktív anyagok. Ez azt jelenti, hogy bármelyik lehet a három lehetséges reakció mechanizmusokat a felszínen, vagy valódi micelláris katalízis IFC-válasz. A körülményektől függően lehet megvalósítani, ezek a mechanizmusok. Ahogyan korábban már kimutattuk, ha lehetséges extrakciós IFC sav formában ionpár R4N + X ---- HY [57]. Korai munka. amely tartották egy sav-IFC elszappanosítási bizonyult hibás [1202 1348]. Azonban az utóbbi időben ez ismertetett enyhe és szelektív hasítása terc-butil-észterek. amely akkor keverés közben a [c.250]
Állás közben dietil-étert 130-140 ° több vegyületet (táblázat. 5 opyt26) kapunk nyomáson etilén jelenlétében terc -butilperoksida és sósav. Etilálás folytatta a normális rendszer. kapott szek-butil-etil-éter. di Vgoru-butil-észter (etilációja mindkét szekunder szénatom-észter), hogy 1-metil-1-etil-propiletilovomu-éter (etilezési egy tercier szénatomon elsődleges termék) és etil-1-metilpentilovomu kapott észter telomerizációs primer alkilcsoport két etilén-molekula. Kaptunk, továbbá, számos közös Xu észterek. Az így kapott terméket [c.146]
TAKE bájt nem nagy feleslegben, az elegyet melegítjük visszafolyató hűtő alatt képződését eredményezi egy bizonyos mennyiségű észter. Üzenetfogadási alkil- szulfonil-kloridot hevítésével egy alkohollal [145] azt mutatja, hogy ebben az esetben ekvimoláris mennyiségű alkohollal vesszük, vagy egy reakciót hajtjuk végre egy rövid időre. n-propil- és n-butil-észterek p-toluolszulfonsav kitermeléssel 25-30% kapunk közben visszafolyató hűtő alatt szulfonilkloridot egy 10% feleslegben vett alkoholos [146]. Miközben száraz levegőt a keverék p-toluolszulfonil-klorid és n-propil-alkohol 100-125 ° eltávolítása érdekében keletkezett hidrogén-kloridot [147] A kapott 70% vegyületet és körülbelül 5% étert. A reakcióelegyhez adunk kis mennyiségű nátrium-karbonátot, hogy semlegesítse a p-toluol-szulfonsav, amely lehet kialakítva, amelyet egy mellékreakció. Másik mellékterméke nyilvánvalóan etil-klorid. bár ő nem szerepel a jelentésben. Hevítve benzolszulfonil-klorid és metil-alkohol egy lezárt csőben 160 ° csak reakció útján kapott termékek a metil-klorid és benzol-szulfonsav [144]. Szekunder és tercier alkoholok. Valószínűleg könnyebb alakulnak kloridok hatására szulfonil-kloridot. mint primer alkoholok. Azonban a kísérleti adatok ezt a kérdést nem állnak rendelkezésre. A jelenléte d-atom a klór a molekula az alkohol csökkenti a mellékreakciókat. és visszafolyató hűtő alatt p-toluolszulfonil-klorid és feleslegben etilén nem képződik, vagy diklór-etán, éter, észter és [148]. Ugyanilyen hatást ciano - át forralás xilolos oldatot R-tsianoetilovogo. alkohol p-toluolszulfonil-kloridnak több órán át termeli a megfelelő észtert 65% -os kitermeléssel [149]. [C.336]
A három leginkább butilének nagy a reaktivitása az izobutilén, de ez könnyen polimerizálódik jelenlétében SAS 0 (C2H5) 2. Ezért, a 50 és 97 ° C helyett, a várt észtert képződött olajos polimerek izobutilén. Szobahőmérsékleten izobutilén ecetsavval 2 órán át. képez terc, butil-acetát, a hozam 59% az elméleti. Ilyen észter hozama marad több órán át, majd csökkenni kezd, és 24 órával. vsledstvii disszociációs észtert redukálva 25% - Per izobutilén aktivitást de 2-butén. Ez a szénhidrogén a tartományban normális olefinek a legaktívabb összekötő savak. A melegítéssel az ecetsavval és benzoesavak jelenlétében SAS-0 (C2H5) g 24. 97 ° C-on ad vtor.butilovye e savak észterei, a hozam a 66 és 89%, ill. Fűtés triklórecetsavval 97 ° C-on 2 órán át. Ez ad sec, butiltrihloratsetat hozammal 91%. [C.13]
Isostructure izovaleriánsav emelt hőmérsékleten elősegíti inkább könnyű polimerizációs butén-2. Ezért, bár a hozam izovaleriánsav-észter vtor.butilovogo valamivel alacsonyabb, mint a vajsav. amint az a kísérletek eredményeit. táblázatban. 9, mentes butén-2 hőmérsékleten 97 ° C-on és 24 óra alatt marad, és a reakcióelegyet ampulla nélkül nyílnak jelentős belső nyomás. [C28]
A kísérleti adatok a táblázatban mutatjuk be. 16, úgy tűnik számunkra, nagyon érdekes, különösen, ha összehasonlítjuk az adatokat a sav és but-2-. A hőmérséklet 50 ° C-on klór-ecetsavval alkilezzük butén-1 első gyorsabb az első két órában vtor.butilovogo hozam-észter [c.37]
A során a szerves kémia fizikai (1972) - [c.122]