Elválasztási eljárások keverékek „(Grade 8) - a dokumentumot - oldal
Az elegyet különböznek egymástól megjelenésű.
A keverékek osztályozása az alábbiak szerint:
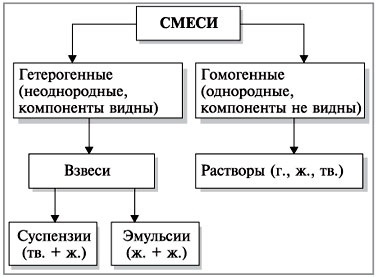
Adjon példákat szuszpenziók (folyami homok + víz), emulziók (olaj + víz) és megoldások (levegő a lombikba, só + víz, a kis érme alumínium vagy réz + nikkel + réz).
Elválasztási eljárások A keverékek
A természetben van olyan anyagok a keverékek formájában. Laboratóriumi kutatások, az ipari termelés az igényeinek gyógyszertan és orvoslás szüksége tiszta anyagokat.
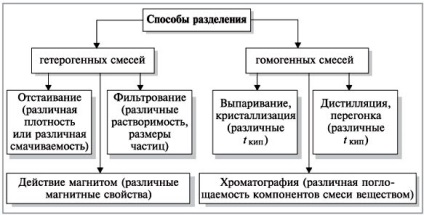
Különböző módszerek keverékeinek szétválasztására használt anyagok tisztítására
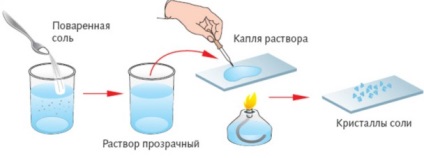
Vyparivanie- kiválasztási oldjuk folyékony szilárdanyag módon történő átalakulást gőzzel.
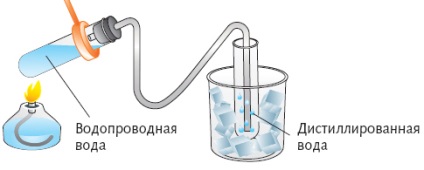
Lepárlás-desztillációs elválasztási tartalmazott folyékony anyagok keverékei forráspontok majd lehűtjük gőzzel.
A természetben a víz tiszta formában (só nélkül) nem fordul elő. Óceán, tenger, folyó, jól és forrásvíz - a különféle sós oldatok. Azonban gyakran az embereknek szükségük van a tiszta víz nem tartalmaz sót (használt autómotorokban, vegyipari termelés különböző folyadékok és anyagok gyártásában kép). Ez a víz úgynevezett desztilláljuk, és eljárás ezek - desztillációval.
Filtrovanie- perkolációs folyadékok (gáz) egy szűrőn keresztül, azzal a céllal, hogy a tisztítási a szilárd anyagok.
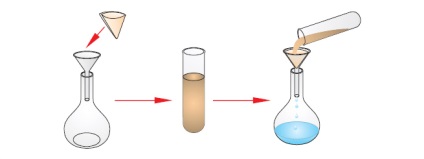
Ezek a módszerek alapulnak a különbségeket a fizikai tulajdonságai a keverék komponensei.
Tekintsük a elválasztási módszerekkel geterogennyhi homogén keverékek.
A vas mennyisége is 0,25 mól. Megtalálható egy csomó belőle:
MFE = 0,25 • 56 = '14
Most ki lehet számítani a tömeghányada fémek a keverékben:
ωFe = MFE / mvsey keveréket = 14/20 = 0,7 = 70%
Válasz: 70% vasat, 30% rezet.
2. példa Ha a működés során a keveréket az alumínium és a vas tömege 11 g sósav feleslegét gázt kiosztott 8,96 liter (STP). Határozza meg a tömegarányai fém a keverékben.
A második példában, mind adja meg a reakció a fém. Voltak hidrogénatom a sav felszabadul mindkét reakcióban. Ezért a közvetlen számítása nem használható. Ilyen esetekben célszerű eldönteni segítségével egy nagyon egyszerű rendszer egyenletek, figyelembe az x - mólszáma az egyik fém, és a y - mennyisége a második anyag.
2. példa Solution.
Találunk a hidrogén:
n = V / Vm = 8,96 / 22,4 = 0,4 mol.
Tegyük fel, hogy az összeg az alumínium - x mol és vas van mol. Akkor lehet kifejezni x és y, a hidrogén mennyisége:
Megoldani egy ilyen rendszer sokkal kényelmesebb módszer kivonás, szorzás az első egyenletet 18:
27x + 18U = 7,2
kivonjuk az első a második egyenletből:
(56-18), y = 11-7,2
y = 3,8 / 38 = 0,1 mól (Fe)
x = 0,2 mol (Al)
Következő találjuk a fém tömegek és a tömegüket frakciók a keverékben:
illetve
ωAl = 100% - 50,91% = 49,09%
A: 50,91 tömeg% vasat, 49,09% alumínium.
Példa 3,16 g keveréket kapunk, cink, alumínium és réz kezeljük feleslegben sósavoldattal. 5,6 liter gázt (STP), és az oldathoz 5 g. Határozza meg a tömegarányai fém a keverékben.
A harmadik példában, két fémet reagálnak, és egy harmadik fém (réz) nem reagál. Ezért maradékot 5g - a súlya a réz. A mennyiségű egyéb két fémek - az alumínium és cink (vegye figyelembe, hogy össztömegük 16-5 = 11 g) megtalálható az egyenletek példa szerint №2.
Response to 3. példa: 56,25% cinket, 12,5% alumínium, 31,25% rezet tartalmaz.
Példa 4.A keverék vas, alumínium és réz járt feleslegben hideg, koncentrált kénsavban. Ebben a részben a keverék oldatot, így 5,6 liter gázt (STP). A maradék elegyhez fölös nátrium-hidroxid-oldattal. Mark és 3,36 liter gáz maradék 3 g oldhatatlan maradékot. Annak megállapításához, a tömege és összetétele a kiindulási fémek keveréke.
Ebben a példában, emlékeztetni kell arra, hogy a hideg, koncentrált kénsavban nem reagál a vas és alumínium (passziválás), de reagál rézzel. Ez a közlemény a kén-oxid (IV).
Reakciók csak egy alkálifém-alumínium - egy amfoter fém (más, mint az alumínium, lúgban oldódó több cink és ón, forró tömény alkáli - Több feloldhatjuk berillium).
4. példa Solution.
Tömény kénsavval réz reagál csak, a móljainak száma a gáz:
nSO 2 = V / Vm = 5,6 / 22,4 = 0,25 mol
A móljainak száma hidrogén:
NH3 = 3,36 / 22,4 = 0,15 mol,
A mólarány az alumínium hidrogén 2: 3, és következésképpen,
nAl = 0,15 / 1,5 = 0,1 mol.
alumínium Súly
Mal = N • m = 0,1 • 27 = 2,7 g
A maradékot - a vas tömege 3 volt lehetséges, hogy megtalálják a keverék tömegének:
msmesi = 16 + 2,7 + 3 = 21,7 g
Tömegtörtje fémek:
A: 73,73 tömeg% rezet, 12,44% alumínium, 13,83% vasat.
Példa 5.21,1 g cink és alumínium elegyében oldjuk 565 ml salétromsavat tartalmazó oldatot 20 tömeg. % HNO3, amelynek a sűrűsége 1.115 g / ml. A kötet a a fejlődő gáz, amely egy egyszerű anyag, és az egyetlen termék a salétromsav helyreállítási volt 2,912 liter (STP). Határozza meg a kapott oldatot összetétele tömeg százalék. (RCTU)
A szövegben ez a probléma egyértelműen meghatározott termék nitrogén hasznosítás - „egyszerű anyag”. Mivel salétromsavat fémekkel megakadályozza hidrogénatom, akkor - a nitrogén. Mindkét fémek oldunk sav.
A probléma kérték nem része a kezdeti fémek keveréke, és az összetétele a kapott oldatot a reakció után. Ez teszi a feladat nehezebb.
Az oldatot az 5. példa.
Határozzuk meg a gáz mennyisége anyagok:
NN2 = V / Vm = 2,912 / 22,4 = 0,13 mól.
Határozza meg a tömeg salétromsav oldatot, a súly és a mennyisége anyag oldott HNO3:
mrastvora = ρ • V = 1,115 • 565 = 630,3 g
mHNO3 = ω • mrastvora = 0,2 • 630,3 = 126,06 g
nHNO3 = m / M = 126,06 / 63 = 2 mol
Megjegyezzük, hogy mivel a fém teljesen fel nem oldódik, majd - elég pontosan savat (vízzel, ezek a fémek nem reagálnak). Ennek megfelelően, szükség lesz, hogy ellenőrizze, hogy a sav nem volt feleslegben. és mennyi maradt belőle a reakció után a kapott oldatban.
Felel reakciók (ne felejtsük el, a elektronikus mérleg), és, a kényelem a számítás, átveszi 5x - mennyiségű cink, és több mint 10 éves - az alumínium mennyisége. Aztán, az együtthatóknak megfelelően az egyenletekben, hogy x mol nitrogén-az első reakcióban, és a második - 3Y mol:
A következő kérdés az, hogy marad a Salétromsavoldaioi és mennyi van bízva?
A reakció egyenletek, a sav mennyisége elő:
nHNO3 = 0,48 + 1,08 = 1,56 mol,
azaz diecetsav feleslegben, és ki lehet számítani az egyensúlyt a megoldás:
nHNO3 keletre. = 2-1,56 = 0,44 mol.
Tehát a végső oldat:
cink-nitrát 0,2 mol:
MZN (NO3) 2 = n • M = 0,2 • 189 = 37,8 g
alumínium-nitrát mennyisége 0,3 mol:
Mal (NO3) 3 = n • M = 0,3 • 213 = 63,9 g
felesleges salétromsav mennyisége 0,44 mól:
mHNO3 keletre. = N • M = 0,44 • 63 = 27,72 g
Mi a súlya a végső megoldás?
Emlékezzünk, hogy a súlya a végső oldat az alábbi elemekből áll, hogy mi vegyes (oldatok és anyagok), kivéve azokat, a reakciótermékeket, amelyek mentek ki az oldatból (csapadék és gázok):
A tömegek összege
vegyes
oldatok és / vagy anyagok
Akkor mi a probléma:
mnov. oldat = tömege sav + tömeges fémötvözetből - súlya nitrogén
Mn2 = n • M = 28 • (0,03 + 0,09) = 3,36 g
mnov. oldat = 630,3 + 21,1-3,36 = 648,04 g
Most ki lehet számítani a tömeghányada az anyagnak a kapott oldatot:
A: 5,83% cink-nitrát, alumínium-nitrát, 9,86%, 4,28% -os salétromsavat.
6. példa Ha a feldolgozás 17,4 g keveréket a réz, vas és alumínium feleslegét tömény salétromsav kinyerjük gáz 4,48 L (STP), és a kereset a keveréket az azonos tömegű sósav feleslegét - 8,96 liter gázt (STP). Határozzuk meg az összetétele a kiindulási keverékben. (RCTU)
A probléma megoldására azt kell felidézni, hogy először is a tömény salétromsavat egy inaktív fém (réz) ad NO2. és vas és alumínium nem reagálnak rá. Sósav, ellentétben, nem reagál a réz.
Response to 6. példa: 36,8% rezet, 32,2% vasat, 31% alumínium.
Kapcsolódó dokumentumok:
Munka tananyag
8. évfolyamon. 8.§, a munkát otthon 8.1. Töltse ki a táblázatot, amelyben összeveti a sposobyrazdeleniyasmesey. Előnyök és hátrányok sposobovrazdeleniya kell becsülni költség.
Razdeleniesmesey fogalma razdeleniismesey és tisztító anyagok. Néhány a legegyszerűbb sposobyrazdeleniyasmesey. szűrés, razdeleniesmesey. O.S.GABRIELYAN, I.G.OSTROUMOV, A.K.AHLEBININ indul a kémia 7. osztály Folytatás. Kiindulási cm. A № 1, 2, 3, 4.
Tiszta anyagok és ezek keverékei. Sposobyrazdeleniyasmesey. Hogy képet alkossunk a tiszta anyagok és keverékek. A tisztítási eljárások az anyagok. anyagok különböző típusú szerves vegyületek. Jellemző: A fő osztályok a szerves vegyületek.
értékelését a diákok ismereteit a lehetőségeket és sposobahrazdeleniyasmesey anyagok; képezzük a megfelelő kísérleti készségek. Osztályozás és kémiai tulajdonságait az fő osztálya szervetlen vegyületek, képződését ábrázolások.
keveréket. sposobyrazdeleniyasmesey. Célkitűzések: Ahhoz, hogy egy ötlet a tiszta anyagok és keverékek; Tekintsük besorolás ezek keverékei; Ahhoz, hogy megismertesse sposobamirazdeleniyasmesey. tanuló és emeli kártyát az osztályban a képlete a szervetlen anyag.