Előadás vegyértékétől
1 Valence. Valence lehetőségeit és méretei atomok kémiai elemek.

2. Mi a vegyértéke? „Valcncy kémiai elem -, hogy képes kombinálni más atomok atomok specifikus arányban.” „Valcncy - képessége atomjai egyik elem csatlakoztatása egy bizonyos számú atomja másik elem.” „Valcncy - atomok tulajdonság áteső kémiai vegyület, ad, vagy egy bizonyos számú elektronok (electrovalence) vagy elektronok együtt egy közös a két elektron pár atomok (kovalens)”.

3 Valcncy és vegyérték lehetőségek - fontos jellemzői a kémiai elem. Ezek szerkezete határozza meg az atomok és periodikusan változtatjuk növekvő nukleáris díjakat. Mi az Ön véleménye, a koncepció a „vegyértékű lehetőséget.”

4 „Az a képesség, - olyan állapotba kerüljön valami”; „Lehetséges - mint például előfordulhat megvalósítható megengedett, megengedett elképzelhető.” szótár S.I.Ozhegova

5 atomos vegyértékeinek lehetőségek - megengedhető vegyértéke elemet, a teljes körű értékek különböző vegyületek.

6. ábrán tehát szén-vegyértéke IV miatt pár feltörése 2s 2 - elektronok és az átmenet az egyik az üres orbitális. Üres - szabad, üres (SI Ozhegov).
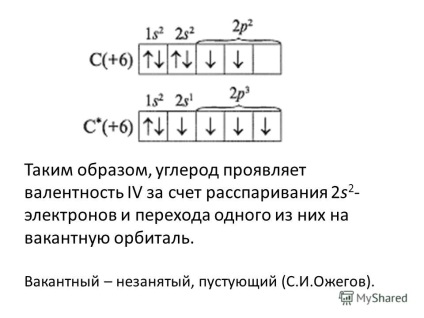
7 Miért vegyértékű C - II és a IV, és H - I, a He - 0, Be - II, B - III, P - V? Összehasonlítás az elektron diffrakciós Formula elemek és meghatározni az oka a különböző vegyértékek

8 És mi határozza meg a vegyérték a vegyérték és a lehetőséget az atomok? Vizsgáljuk meg e két fogalom viszonyát energiafogyasztás (E) a fordítását az atom gerjesztett állapotban kompenzálja a felszabaduló energia a kialakulását a kémiai kötés.
9. Mi a különbség az atom a földbe (stacionárius) állapotában az atom gerjesztett állapotban? Következtetés vegyérték-atomok kémiai elemek határozzák: 1) száma párosítatlan elektronok (egy-elektron pályák); 2) jelenlétében a szabad pályák; 3) jelenlétében, a nem megosztott elektron pár.

10 Lehet vegyértékű következő elemeket: Li - III, O - IV, Ne - II? Indokolja válaszát, az elektronikus és az elektron-diffrakciós formulák ezen elemek. Nem t. K. Ebben az esetben, az energia költségek a mozgását elektron (1s 2p és 2p 3S) olyan nagy, hogy nem lehet őket kompenzálja a felszabaduló energia képződése során a kémiai kötés.
11 Van egy másik fajta lehetséges vegyértéke atomok - a jelenléte magános elektronpár (kovalens kötés kialakulását a donor-akceptor mechanizmus): oxigénatom biztosítja a közös elektronpárt kialakulását hidrónium-ion, azaz Ez egy donor és egy hidrogénion-akceptor.
12 Quest otthon 5 bekezdés problémák 12, 13, 16 (y), 14 (n), o. 22 Feladatok 3, 4, p. 23