Elektromos áram folyadékok és olvadékok
Elektrotechnikai berendezések: Az alapok
Elektromos áram folyadékok és olvadékok
A szabad töltéshordozók - ionok
Ingyenes elektromos töltések nem csak a fémek és ez nem csak az elektronokat. Van is ingyenes töltéshordozók, amelyek úgynevezett - ionok. Mik ezek, és mi a különbség az elemi részecskék, mint az elektron, proton, neutron, foton? Jó kérdés.
Ezek közös jellemzője, hogy mindkettő (kivéve a neutron és foton) egy bizonyos mennyiségű elektromos töltés. Mert elektronok és protonok - mindig az elemi töltés és az ion töltése mennyiség több, mint egy elemi, hanem mindig a többszöröse. Következő a közösség - az ő szabadon. Mindkét nem kapcsolódó, s így szabadon változtat azon a tényen, hogy mozgás hatására elektromos tér.
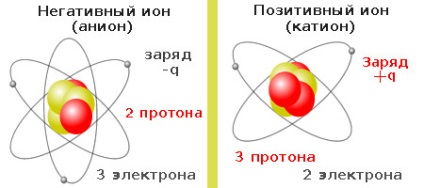
Különbségek ionok és az elemi díjak (proton, elektron), hogy ionok - ez a kémiai anyagok atomjait a periódusos és izotópok. Ezek az atomok a jellemző. Összetételét, ezek több elektront, mint amennyi szükséges-e, vagy elvesztették elektronokat. Ez lehet egy csomó elektronok egy atom, vagy csak egy. Amellett, hogy az elektron egy atom több és protonok, de a veszteség vagy csatlakozási jelenti a nukleáris reakciók, és a változás a szerkezet az atom. Ionok is többszöröse atomi kötések - azaz, molekulák és gyökök. De nézzük az egyszerűség kedvéért a példákban alapuló tartalmaz.
A ionok a két karakter - pozitív és negatív + Q-Q csoport. Annak érdekében, hogy az atom (+) töltés, bár elég lenne elveszíteni egy elektron pályájának, akkor a mérleg kell majd bontani, és nem lesz több proton, mint az elektronok. Van egy hiány, hiányzó elektronok, az atom kezd vágynak, hogy egy új elektron. Egy ilyen atom átalakítjuk egy pozitív ion, vagy pedig nevezzük több kation. Ahhoz, hogy egy negatív ion (-). amely más néven egy anion. kellően elektromosan semleges atom, amelyhez legalább egy plusz elektron.
Elektromos áram szabad töltések - ionok
vezetési áram. amely létezik fémek, ahol a szabad töltéshordozók elektronokat, és az áram a folyadékok és olvadékok, azzal jellemezve, hatásokat. Persze, van egy csomó közös, először is - az átfolyó villamos dq / dt nem egyenlő nulla, vagyis a keresztmetszet irányára merőleges elektromos áram díjat mértékű változás. Szintén az elektromos áram akció kíséri megjelenése formájában energiát hősugárzás és mágneses jelenségek. A különbség lehet megkülönböztetni elsősorban elektrokémiai átalakulások olyan anyag, valamint a legtöbb esetben hiányzik a képesség, hogy árnyékolva a külső elektromágneses mezők.
Amellett, hogy ezek a különbségek, van egy fontos pont. A létezését elektromos áramforrás van szükség. Nehéz megtalálni áramgenerátort, ami sugárzott belőle ionok, gyakorlatilag minden ismert a villamos energia - forrásai szabad elektronokat. Ez annak a ténynek köszönhető, hogy az ionok - instabil állapotban atomok és molekulák, szemben a stabil és mindenütt elektronok.
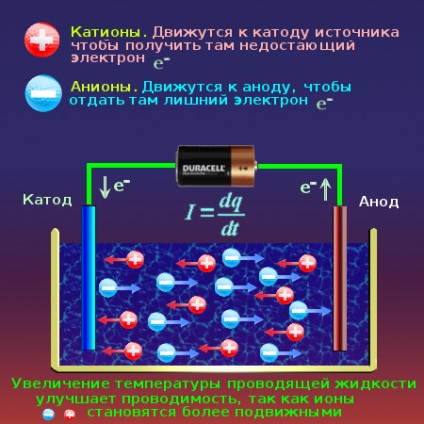
Amikor a vezeték álló szabad ionok végbemegy villamos, ahol a forrás az egyik pólus van feleslegben az elektronok, és a másik a hátránya elkerülhetetlen szabad ionok egyik végén hiányzik a elektronok és semleges lesz, és a másik végén, amely túl elektronok ionok - adnak túl sokat, és szintén semleges lesz. Beszéd nyelvén kémia, van egy reakció az elektrokémiai redukciós és oxidációs. Ahol ionok adnak hiányzik elektronok katód ( „mínusz”), és elérte a ionokat nevezzük kationok. Ahol rob ionok, úgynevezett anionok, felesleges elektronok, nem lesz az anód ( „plusz”).
Kationok elmozdulni a katód. Az anionok elmozdulni az anód. Amikor hivatkozva a polaritás tápegységek most képviseli pontosan anód és a katód. Katód - a „mínusz” jel a forrás, és az anód - „plusz” jel, hogy a forrás. A vezeték, ahol a szabad hordozók - elektronok, amely felelős (-) jel. jelenlegi forgalom megy a katód felől az anód, vagyis a „mínusz” a „plusz”.
Furcsának tűnhet, hiszen a szakirodalom általában jelöli a nyíl irányában a jelenlegi, és ez jelenik meg jön a „plusz” és „negatív”. Ne hagyja, hogy megtévessze. Az a tény, hogy az eredeti „plusz” kifejezés a többlet villamos és „mínusz” hiba. Elektromosság folyt arról a helyről, ahol a sok, ha nem létezik, de ha azt várja, hogy. Ezen túlmenően, a villamos két csoportra oszthatók, a pozitív és negatív. az elektron, megadva a jel (- -), majd a elemi töltés észlelt. Ennek eredményeként nem volt egyféle villamosenergia - negatív. de a polaritás jelölése a szokás mind a pozitív elektromosság. Ezért, és mutatja az aktuális irányt a „plusz” és „negatív”. bár valójában nincs mozgás díjak forgalom.
Ha van egy karmester, ahol csak az anionok fognak mozogni az anód felé, ha a vezető csak kationok, akkor elmozdulni a katód. Mindig éppen ellenkezőleg, ez egy plusz mínusz és plusz mínusz. Könnyen lehet, hogy a vezetéknek van mindkét típusú ionokat, míg mindegyik mozog a javukra. Ennek eredményeként, a forgalom mindkét irányban. A kérdés. Mi a helyzet az aktuális értéket? Mint ahogy kiderült, hogy az egyik ment át a szakasz száma díjak (anionok) és egyéb publikált mennyiség (kationok). Ebben az esetben a díjak összeadódnak, tekintettel a polaritás jeleket.
Egy másik különbség a vezetési áram hőmérsékletfüggő. A fémek, hőmérséklet növeljék vezetőképesség romlik, az ellenállást a fémek növekszik melegítés hatására. Abban az esetben, inverz függőség vezetőképes folyadékok. A hőmérséklet-növekedés javítja a mobilitás ionok hevítve vezetőképes folyadékok azok ellenállása csökken.
Elektrolitok és olvadékok
Sok kémiai vegyületeket vízben oldjuk. Ez az oldódási nevezzük elektrolitos disszociáció. De disszociációs lehetséges részvétele nélkül a víz. Elég, hogy olvad a kristályok kémiai vegyületek, és hogy megkapja az olvadék. A víz egy fenomenális képes feloldani önmagában szinte minden kémiai elemek. Oceans oldott ionok lényegében minden eleme a periódusos rendszer.
Mind meg kellett enni elektrolitok, ha csak azért írunk mi a só és a víz elektrolit. Azonban, meg kell jegyezni, hogy az oldódás cukor vízben - ez nem egy elektrolit, mert nincs bontás cukormolekulák ionokra.
A gyomornedv, a vér, nyirok, minden folyadék az emberi szervezetben az elektrolitok. Veletek vagyunk, állatok, növények - minden áll elektrolitok. És pontosan mi az elektrolit? Úgynevezett elektrolit oldatot (általában víz) vagy ion olvadék. Minden elektrolitok nevezzük vezetők a második fajta. Különbséget tenni a gyenge és az erős elektrolitok disszociációfok. A legtöbb szervetlen savakkal utal az erős elektrolitok, de a víz egy gyenge elektrolit. Ugyanakkor a víz még mindig tartják a vezető a második fajta. A desztillált víz egy gyenge elektromos vezető, de ez csak az, hogy feloldódjon só, vagy adjon hozzá egy savas vagy lúgos, így a vezetőképesség jelentősen javult.
Az elektrolitok alkalmazott elektrokémiai cellák, mint a galvánelemek és akkumulátorok. Az ipari folyamatokban galvanizáló és elektrokémiai, elektrolitok és alkalmazott elektrokémiai folyamat fut során keresztül folyó elektromos folyadék.
anyag megolvad ahogy vizes elektrolitok vezetők a második fajta, és nevezhetjük elektrolitok. Ahhoz, hogy az alumínium alumínium-oxid segítségével, az ő olvadékok. Elektromosság vezetünk át alumínium-oxid, és van elektrolízis folyamat, és az egyik elektróda alumínium megjelent. Ez nagyon energiaigényes folyamat, de ez hasonló ahhoz, ahogy a víz bontjuk hidrogén és oxigén hatása alatt az elektromos áram.
folyékony dielektrikumokban
Nem minden a folyékony elektrolitot nem minden elolvad tartalmaz szabad ionok. Ha az oldat nem szabad ionok számára, és csak kis számú szabad elektronok, ez a megoldás áramvezetôvé rajta lehetséges átjárást az elektromos áram, de ez a megoldás nem nevezhető vezető a második fajta, és minél több vezeték az első fajta. Egy ilyen anyag úgy viselkedik, mint egy dielektromos és szigetelő tulajdonságokkal több, mint a vezetőképesség.