Az elmélet a szerkezet a szerves vegyületek homológjait és izomerjeit (szerkezeti és térbeli)
Home / elmélet, hogy felkészüljenek a vizsgára / 3.1. Az elmélet a szerkezet a szerves vegyületek, homológjai és izomerjei (szerkezeti és térbeli). Kölcsönös hatása atomok molekulák.
Szerves kémia - kémiai rész, amelyben a tanulmány a szén-vegyületek, ezek szerkezete, tulajdonságai és egymásba.
A neve a fegyelem - „Organic Chemistry” - volt elég hosszú idő. Ennek oka abban a tényben rejlik, hogy a legtöbb szén vegyületek, a kutatók találkoztak a kezdeti szakaszban a kémiai tudomány volt növényi vagy állati eredetű. Azonban, mint egy kivétel, az egyes szén-vegyületek kapcsolódnak szervetlen. Így például, a szervetlen anyagokat tekintik a szén-oxidokkal, szénsav, karbonátok, hidrogén-karbonátok, hidrogén-cianid, és mások.
Jelenleg tudjuk, hogy egy kicsit kevesebb, mint 30 millió különböző szerves anyagok, és ez a lista folyamatosan frissül. Ilyen nagyszámú szerves vegyületek oka elsősorban az alábbi specifikus tulajdonságai a szén:
1) szénatom lehet egyesítenek egy lánc tetszőleges hosszúságú;
2) lehetőség van nem csak szekvenciális (lineáris) vegyület szénatomok egymással, hanem az elágazó és gyűrűs sőt;
3) lehetséges különböző típusú kötvények közötti szénatomot tartalmaznak, mégpedig, egyetlen, kettős és hármas. Így vegyérték szén szerves vegyületek mindig négy.
Ezen túlmenően, a legkülönbözőbb szerves vegyületek, valamint hozzájárul az a tény, hogy a szénatomok kialakítására képes kötést tartalmaz, és még sok egyéb kémiai elemek, mint a hidrogén, az oxigén, nitrogén, foszfor, kén, halogének. Ebben az esetben, hidrogén, oxigén és nitrogén a leggyakoribb.
Meg kell jegyezni, hogy a hosszú ideig képviselte a szerves kémiában tudósok „sötét erdő”. Egy ideig, még a tudomány életfilozófia volt népszerű elmélet, amely szerint a szerves anyagok nem szerezhetők „mesterséges” módon, azaz a él számít. Azonban az elmélet életfilozófia tartott nem túl hosszú, annak a ténynek köszönhető, hogy egy-egy kimutatható anyag, amelynek szintézise lehetséges kívül élő szervezetekre.
A kutatók rejtélyes tény, hogy sok szerves vegyületek azonos minőségi és mennyiségi összetétele, azonban gyakran meglehetősen eltérő fizikai és kémiai tulajdonságai. Így például, dimetil-éter és az etanol pontosan azonos elemi összetételű, de dimetil-normál körülmények között, a gáz és etil-alkohol - folyadék. Ezen túlmenően, dimetil-éter és nátrium-nem reagál, és az etil-alkoholt reagáltatnak úgy, felszabadító hidrogén gázt.
A kutatók a XIX században készült egy csomó feltételezések arról, hogy minden ugyanaz rendezett szerves anyagok. Az alapvető feltételezések terjesztett elő a német tudós F.A.Kekule, hogy először azt az ötletet, hogy az atomok különböző kémiai elemek konkrét értékek vegyértékek, és szén-atomok a szerves négyértékű, és képes csatlakozni egymással alkotnak egy láncot. Később, kezdve Kekulé feltételezések magyar tudós, Alekszej Mihajlovics Butlerov kifejlesztett egy elméletet szerkezetének szerves vegyületek, amelyek nem vesztette el relevanciáját ma. Tekintsük alapfeltevéseihez ezt az elméletet:
1) az összes atomok a molekulák a szerves anyagok csatlakoztatva egymáshoz sorrendben aszerint, hogy azok vegyértékének. Szénatomokon van állandó vegyértéke azonos négy, és alkothatnak egy lánc eltérő szerkezetű;
2) a fizikai és kémiai tulajdonságok bármely szerves anyag nem elég a molekuláris szerkezetét, hanem a sorrendben atomi kötések a molekulában együtt;
3) az egyes atomok és csoportok az atomok egy molekulában befolyásolják egymást. Az ilyen beavatkozás tükröződik a fizikai és kémiai tulajdonságai a vegyületek;
4) vizsgáljuk a fizikai és kémiai tulajdonságai, a szerves vegyület lehet létrehozni a szerkezetét. Ellenkezője is igaz - ismerve a molekuláris szerkezet, anyag, tulajdonságait jósolható.
Ugyanúgy, mint a periodikus törvény D.I.Mendeleva lett a tudományos alapjait a szervetlen kémia, szerkezet elmélete a szerves anyagok AM Butlerova valóban lett a kiindulópontja a fejlesztés szerves kémia mint tudomány. Meg kell jegyezni, hogy létrehozása után az elmélet a szerkezet Butlerova szerves kémia kezdte fejlődés nagyon gyors ütemben.
Izoméria és homológia
Szerint a második helyzetbe Butlerova elméletet, a tulajdonságait szerves anyagok függ nemcsak a minőségi és mennyiségi összetétele a molekulák, hanem a sorrendben atomi kötvények ezen molekulák egymással.
Ebben az összefüggésben, a jelenség a izoméria elterjedt szerves anyagok.
Izomériát - egy jelenség, amikor különböző anyagok pontosan ugyanolyan összetételű molekulák, azaz molekuláris képlete megegyezik egymással.
Nagyon gyakran az izomerek különböznek a fizikai és kémiai tulajdonságok. Például:
típusú izoméria
strukturális izomer
a) egy szénváz izoméria
c) Interclass izomer:
Interclass izoméria lép fel, amikor a vegyületek izomerek különböző osztályaiba tartoznak, a szerves vegyületek.
régióizomereket
Regioizomereket - olyan jelenség, amikor a különböző anyagok az azonos kapcsolási rendje atomok egymáshoz különböznek egymástól rögzített helyzetű különböző atomok vagy atomcsoportok térbeli.
Kétféle térbeli izoméria - geometriai és optikai. Célokat a optikai izomer nem található a vizsga, ezért úgy csak geometriai.
Ha egy molekula vegyület kettős C = C kötés, vagy egy ciklus, néha az ilyen esetekben lehetőség van a jelenség a geometriai vagy cisz-transz-izomer.
Például, az ilyen típusú izoméria lehetséges, hogy butén-2. Jelentése, hogy a kettős kötés a szénatomok között valójában egy lapos szerkezete és szubsztituensek a következő szénatomok lehet rögzítetten helyezkedik felett vagy alatt, ezen a síkon:
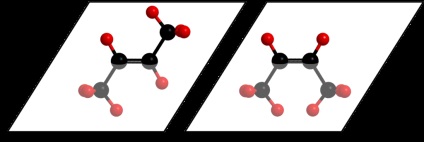
Amikor ugyanaz a szubsztituensek azonos oldalán a sík azt mondják, hogy a cisz-izomert, és amikor a különböző - transz-izomer.
A szerkezeti képletekben a formájában a cisz- és transz-izomerek (például butén-2) van ábrázolva, a következőképpen:
Megjegyezzük, hogy a geometriai izoméria nem lehetséges, ha a legalább egy szénatomot a kettős kötés lesz két azonos szubsztituenst. Például, cisz-transz izomerek nem lehetséges a Skip:
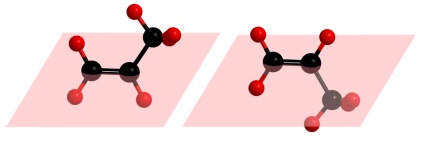
Amint az látható a fenti illusztráció, ha a csere metil-csoport, hidrogénatom található a második szénatom mindkét oldalán a gép, megkapjuk az azonos molekulát, amely csak nézett a másik oldalon.
Hatás az atomok és atomcsoportok egymást szerves molekulák
A koncepció a kémiai szerkezetet, mint egy olyan szekvenciát, melyek az egyes más atomok szignifikánsan fokozott az Advent az elektronikus elmélet. Abból a szempontból ez az elmélet is magyarázni, hogyan atomok és csoportok az atomok egy molekulában befolyásolják egymást.
Kétféle módon lehet befolyásolni egy molekulát az egyéb területek:
1) induktív effektus
2) mezomer hatása
induktív effektus
Annak igazolására, ez a jelenség Vegyük például a molekula a 1-klór-propán (CH 3 CH 2 CH 2 Cl). Bond között a szénatomok között, és a klór poláris, mint a klór egy sokkal magasabb elektronegativitási képest szén. Ennek eredményeként az elmozdulás a elektronsűrűség a szénatomon egy klóratom kapcsolódik egy szénatomhoz képező részleges pozitív töltést (δ +), klóratom - részlegesen negatív (δ-):
Az elmozdulás a elektronsűrűség egyik atom egy másik gyakran jelöli a nyíl mutat a több elektronegatív atommal:
Azonban, az érdekes pont olyan, hogy, eltekintve az elmozdulás a elektronsűrűség az első szénatom egy atom klóratom, is van egy elmozdulás, de kisebb mértékben a második az első szénatomhoz, és a harmadik, hogy a második:
Az ilyen elmozdulás a elektronsűrűség a láncban σ-kötések nevezett induktív hatás (I). Ez a hatás gyengíti a távolság befolyásolja csoportok és már gyakorlatilag nem fordul elő, miután három σ-kötések.
Abban az esetben, ha az atom vagy atomcsoport nagyobb elektronegativitású képest a szénatomokkal azt mondani, hogy az ilyen szubsztituensek mutatnak negatív indukciós hatásának (-I). Így a fenti példában ez negatív indukciós hatásának klóratom. Szintén a klór negatív indukáló hatása a következő szubsztituensekkel:
Ha a elektronegativitása egy atom vagy atomcsoport elektronegativitási kevesebb szénatomosak, valójában van egy átadása az elektronsűrűség az ilyen szubsztituensek a szénatommal. Ebben az esetben azt mondjuk, hogy a szubsztituens pozitív indukciós hatása (+ I) (a elektron).
Így, szubsztituens + I -effect korlátozzák szénhidrogéncsoportok. Az expressziós + I-hatás növekszik nyúlás szénhidrogéncsoport:
Meg kell jegyezni, hogy a szénatomok a különböző vegyértékű állapotban, és is különböző elektronegativitása. A szénatomok SP-hibridizációs állapotban nagyobb elektronegativitású képest a szénatomok sp 2 hibridizációs állapot, amely viszont több, elektronegatív, mint szénatomot az állapotban sp3 hibridizációs.
Mezomer hatása (M). vagy felületkezelő hatás - a hatás a helyettes, rendszeren keresztül továbbított konjugált π-kötések.
Have mezomorf hatás határozza meg ugyanazt az elvet, mint a jel induktív hatása. Ha az a szubsztituens növeli az elektronsűrűség a konjugált rendszer, azt pozitív mezomer hatása (+ M), és egy elektron. Pozitív mezomer hatása van egy szén-szén kettős kötést, szubsztituensek, amelyek egy nem megosztott elektronpárt: -NH2. CHOH, halogének.
Negatív mezomer hatása (-M) rendelkeznek szubsztituensek húz elektronsűrűség a konjugált rendszer, ahol az elektron sűrűsége csökken a rendszer.
Negatív mezomorf hatás van csoportok:
Mivel a újraelosztása elektronsűrűség miatt mezomer és induktív hatások a molekulában bizonyos atomok jelennek részleges pozitív vagy negatív töltést, amely tükröződik a kémiai tulajdonságai az anyag.
Mezomer hatása grafikusan mutatják az ívelt nyíl, hogy kezdődik a központ a elektronsűrűség és végződik ott, ahol a elektronsűrűség eltolódik. Például vinil-klorid molekula mezomer hatása akkor jelentkezik, ha interfész osztatlan elektronpárt egy klóratom, egy π-elektron szénatom közötti kötés. Tehát a keletkező klóratom jelenik parciális pozitív töltéssel rendelkezik, és amelynek mobilitása a π-elektron felhő hatása alatt egy elektronpár felé mozdul a szélsőséges szénatomos alkilcsoport, amely előfordul miatt ez a részlegesen negatív töltéssel:
Ha a molekula váltakozó egyszeres és kettős kötések, akkor azt mondjuk, hogy a molekula tartalmaz egy konjugált π-elektron rendszert. Egy érdekes tulajdonsága a rendszernek, hogy a mezomorf hatást nem csillapodnak.