Az elektronikus konfigurációja az atom
Megjelenik a konfigurációs az atom (a szerkezet a elektronhéjak), akkor kell tudni:
- Helyezze az elem a periódusos rendszerben DI Mengyelejev.
- A teljes száma az elektronok az atom (megegyezik a sorszám).
- A maximális számát elektronok szintjén (2n 2).
- Az eljárás kitöltésére elektron sublevels és pályák t. E. A szekvencia atomi pályák sorrendben növekvő energia.
Nalrmer: oxigén elem sorszám 8 a második időszakban (n = 2) a 6. csoport fő alcsoportok. Ez a P-elem. Er nyolc elektronok vannak elosztva két szinten: az első (K) és a második (L). A 1s és 2s-pályák helyezünk a 2 elektront. Vannak még 4 elektronok kell fektetni a három 2p-pályák. Követve Hund-szabály, tedd egy elektron mind a 2p orbitális.
A negyedik elektron kell párosítva egyike a három elektronok már a 2p pályák tehát helyesen elektron-oxigén grafikai képletű a következő formában:
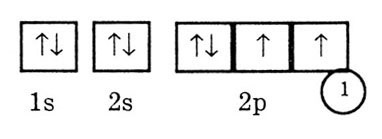
A megfelelő elektron konfiguráció beíródik formájában 2 1s 2s 2p 2 vagy 4 formájában [nem] 2s 2 2p 4. Az elektronok konfigurációs IS2 vagy [nem] képezik a belső héj vagy csontváz, oxigénatom. Elektronikus konfigurációs 2s
2p található a külső héj és tartozik a vegyérték elektronok.
Felhívjuk figyelmét, hogy a szám a csoport tagjait a fő csoport számát mutatja elektronok a külső héj. A oxigén a külső héj 6 elektronok (6. tétel a fő alcsoport).
Feladatok és vizsgálatok a téma „E-atom konfigurációja”
Lessons: 1 Feladat: 9, tesztek: 1
Osztályok: 3. feladat: Vizsgálatok 9: 1
Osztályok 4 feladatok 10 tesztek 1
Osztályok: 3. feladat: Vizsgálatok 9: 1
Osztályok: 3. feladat: Vizsgálatok 9: 1