Az aktiválási energia
Erős változása a reakció sebessége a változás az elmélet megmagyarázza az aktiválási hőmérséklet. Az elmélet szerint a kémia-cal kölcsönhatás lép csak az aktív Molek képletek (részek), amelynek egy energia. elegendő osuschest-előfordulása a reakciót. Az inaktív részecskék előállíthatók aktív. ha azt mondja, a szükséges többlet energiát. - ezt a folyamatot nevezik aktiválást. Az egyik módja, hogy aktiválja - hőmérséklet-chenie visszavonták. ha a hőmérséklet növekszik az aktív fajok jelentősen megnövekedett. ezáltal SKO magasságú drámaian növeli.
Energy. amelynek meg kell tájékoztatni a molekulák (részecskék) a reaktánsok. állítsa őket aktív. Ez az úgynevezett aktiválási energia.
Ez határozza meg empirikusan. betűvel jelöljük E és egy általában kifejezve kJ / mól. Szóval például. egy vegyület, a hidrogén és jód (H 2 + I 2 = H 2 I) Ea = 167,4 kJ / mól. és a bomlási HI (2 H I = H 2 + I 2) Ea = 186,2 kJ / mól.
Az aktivációs energia E egy függ a reaktánsok természetétől és jellemző minden reakció. Ezek a gondolatok magyarázható-minta:
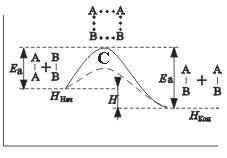
Például ha a reagáltatást az általános formája A 2 + B 2 2 = AB. az ordináta tengelyen a potenciál az energia-rendszerbe, az abszcissza - a reakció. eredeti állapot átmeneti állapot → → véges-nek állapotban. A reagensek A 2 és B 2 formájában pro kek AB reakció. kell leküzdeni az energia akadályt C. Ezen aktiválási energia Ea költenek. ami növeli az értékét az energetikai rendszerek is. Ennek során a reakció a reagensek részecskék Obra-zuetsya instabil köztitermék-wai csoportosítás. az úgynevezett átmeneti állapot, aktivált vagy fürdőszoba-komplex (a C pont), az ezt követő bomlása, amely képződéséhez vezet a végtermék AB. A reakció mechanizmusa lehet ábrázolni áramköri
reaktánsok (kezdeti állapot)
aktivált komplex (átmeneti állapot)
reakciótermékei (egy véges állapotú rendszer)
Ha a bomlás az aktivált komplex kiosztott több energiát. mint amennyi szükséges az aktiváláshoz részecskék. A reakció exo-termikus. Egy példa egy endoterm reakció a fordított folyamat - a kialakulását egy anyag AB vegyületek A 2 és B 2 2 AB = A 2 + B 2 Ebben az esetben, az eljárás akkor is folytatódik képződése útján aktivált komplex A2 B 2 Mindazonáltal, az aktiválási energia nagyobb. mint a közvetlen eljárással. Ed = Ea + # 8710; H (# 8710; H - a reakcióhőt). Endoterm reakciók szükséges energiaellátás kívülről.
Amint az ábrából látható

véges differencia-állapotú energia a rendszer azt (H con) és a primer (H BEG) van a reakcióhőt.
A reakció sebessége közvetlenül függ az értékeket az aktiválási energia. ha kicsi. majd egy bizonyos reakcióidő fogja legyőzni az energia gát egy nagy részecskék számát, és a reakció sebessége magas lesz. de ha az aktiválási energia magas. a reakció lassú.
A kölcsönhatás ion aktiválási energia nagyon kicsi és ionos reakciók mennek végbe a nagyon nagy sebességű (szinte azonnal).