Alcsoport vii a
A molekulák áll két halogénatommal.
A növekvő atomtömeg színe sötétebbé válik, növelve a olvadás- és forráspontja és sűrűsége.
A fluor elektrolízissel előállított egy olvadék kálium-hidrofluorid KHF2 (bomlik csak HF):
Anód: 2F - - 2E → F2
Az iparban, főként klór elektrolízissel előállított vizes nátrium-klorid-oldat:
A laboratóriumban klór hatásával nyert különböző oxidálószerek a hidrogén-klorid:
Hasonló módon állítjuk elő bróm- és jód-, oxidáló HBr, HI, vagy ezek sói:
A kémiai tulajdonságai F2
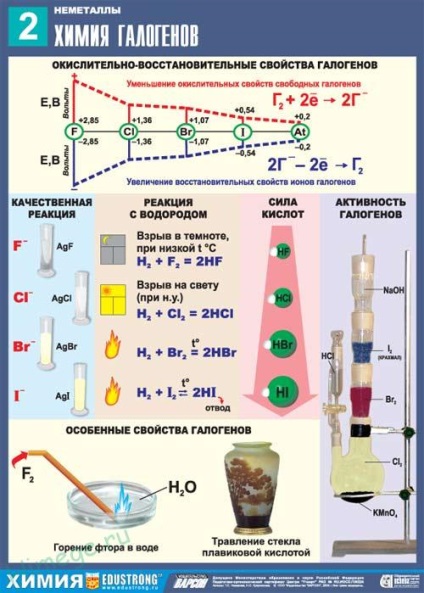
Minden halogének nagyhozzáadott oxidáló aktivitást, ami csökkenti az áthaladó fluor- jód.
Fluor - a legaktívabb halogének, reagáltatjuk összes fémhez kivétel nélkül, sok közülük a fluor- légkörben öngyulladók, felszabadító nagy mennyiségű hőt:
Melegítés nélkül a fluor reakcióba lép számos nemfémek (H2 S, C, Si, P.) - az összes reakció erősen exoterm, ahol:
Hevítve fluor oxidálja az összes más halogének (oxidációs állapotban +1)
Amikor besugárzott fluor reakcióba lép, még inert (nemes) gázok:
A kölcsönhatás fluor komplex anyagok ugyancsak nagyon erőteljesen:
Kémiai tulajdonságok Cl 2
A szabad klór reagál minden egyszerű anyagot, kivéve az oxigén, a nitrogén és a nemesgázok:
A reakciót szénhidrogén helyettesítés és kívül:
Klór képes melegítés hatására kiszorítják bróm- vagy jódatom azok vegyületet hidrogéngázzal vagy fémek:
Reverzibilisen vízzel reagál:
Cl2 + H2 O↔ HCI + HCIO (klór víz)
2NaON + Cl2 → NaCl + H2 O + NaSlO (hideg)
ZSl2 6KON + → + 5KSl KClO3 ZN2 + O (hevítve).
Szerint a kémiai aktivitás bróm foglal egy közbenső helyzetben a klór és jód. Kölcsönhatásba lép számos egyszerű anyagok:
Bróm, valamint a klór, vízben oldjuk, és részlegesen reagáltatjuk vele, képezi az úgynevezett „brómos víz”:
Amikor feloldjuk hideg lúgos oldatok képződnek bromid és hipobromit
2NaOH + Br2 = NaBr + NaBrO + H2 O
Megemelt hőmérsékleten (körülbelül 100 ° C-on) - bromid és bromát:
A bróm reagáltatva jodiddal oldatok szabad jódot megjelent:
Br2 + 2Kir = I2 + 2KBr.
Mivel a szerves anyagok, amelyek kettős vagy hármas kötést. Elszíneződés brómos vizet - minőségi válasz a telítetlen vegyületet:
C2 H4 + Br2 = C2 H4 Br2.
Jód jelentősen eltérő reaktivitása a más halogének. Ez nem reagál a legtöbb nem-fémek, és a fém lassan reagál csak hevítve.
A kölcsönhatás jód hidrogénnel történik csak erélyes melegítés, a reakció erősen endoterm és reverzibilis:
Jód gyakorlatilag oldhatatlan vízben, és nem képes oxidálni is, ha melegítjük; Emiatt nincs „jódos vízzel.”
Azonban, a jód képes feloldani oldatokban jodidok alkotnak komplex anion:
A kapott oldatot nevezzük Lugol oldattal.
Hidrogén-szulfid H2 S, nátrium-tioszulfát-Na2 S2 O3 és egyéb redukáló visszaállítani azt I -:
A klór és más erős oxidáló szerekkel, ez átalakul vizes oldatban IO3 -:
Adszorbeálva keményítő jóddal foltok sötét színű minőségű allergiás reakciót jód.
Így a kémiai-LIC aktivitást halogénatom egymás után csökken fluor- jód. Mindegyik halogén közül F - I kiszoríthatja utáni fúj a vegyületei, hidrogénatom vagy fém, azaz minden egyes halogén, mint egy egyszerű anyag képes oxidálni a halogenid ion a következők bármelyike halogének.