A termodinamika és hőátadás
Ma megpróbálunk választ találni arra a kérdésre: „Heat - ezt. ”. Ebben a cikkben arra gondolunk, hogy egy olyan folyamat, amely a faj létezik a természetben, és tudja, mi a kapcsolat a hőátadás és a termodinamika.
meghatározás

Heat Transfer - egy fizikai folyamat, amelynek lényege az átadása hőenergia. Az Exchange zajlik a két testület közötti, illetve a rendszer. Így előfeltétele hőátadás lesz egy fűtött szervek egy kevésbé fűtött.
folyamat jellemzők
Hőátadás - ez a fajta jelenség, hogy előfordulhat közvetlen érintkezés útján, és jelenlétében osztófalak. Az első esetben, minden világos, de a második test kell használni, mint akadályok anyagok környezetbe. Hőátadás esetén fordulhatnak elő, ha a rendszer, amely két vagy több testet, nincs olyan termikus egyensúly állapotába. Azaz, az egyik objektum egy magasabb vagy alacsonyabb hőmérsékletű, mint a másik. Itt azután a hőerőmű. Logikus feltételezni, hogy be kell fejezni, ha a rendszer jön termodinamikai vagy termikus egyensúly. A folyamat spontán módon, meg tudjuk mondani a termodinamika második törvénye.
Hőátadás módszerek. Hővezető.

Tehát az a tulajdonsága, hogy anyagi teste, hogy az energia átadása. Így adódik át a melegebb része az azonos, hogy a hidegebb. Az alapja ennek a jelenségnek az az elv, kaotikus mozgások molekulák. Ez az úgynevezett Brown-mozgás. Minél nagyobb a hőmérséklet a test, annál inkább mozog a molekulában, mert van egy nagyobb kinetikus energiával. Az eljárás során a hővezető elektronok, molekulák, atomok. Úgy végezzük a szervek, a különböző részeit, amelyek egyenlőtlen hőmérséklet.
Ha az anyag képes elvezetni a hőt, beszélhetünk mennyiségi jellemző. Ebben az esetben ez szerepét játssza a hővezető. Ez a jellemző azt jelzi, hogy mennyi hő áthalad az egyes paraméterek hosszát és terület egységnyi idő alatt. Ebben az esetben, a testhőmérséklet változik pontosan 1 K.
Korábban azt hitték, hogy a hőcsere a különböző szervek (beleértve a hő átviteli keret struktúrák) annak a ténynek köszönhető, hogy a az egyik testrész egy másik az úgynevezett kalorikus áramlások. Azonban jelei annak tényleges létezését, senki sem találta, és amikor a molekuláris kinetikus elméletét kifejlesztett egy bizonyos szintet, minden a kalória és elfelejtettem, hogy úgy gondolja, mert a hipotézis tarthatatlan volt.
Konvekció. A hőátadás a víz

Ily módon a hőenergia cseréjét érteni transzfer belső menet van. Képzeljünk el egy kanna vizet. Mint ismeretes, egy fűtött levegő áramlik felfelé mászni. A hideg, nehezebb esik lefelé. Akkor miért az összes vizet el ez másként? Ő pontosan ugyanaz. És során ebben a ciklusban, minden réteg a víz, nem számít, hány lehetnek, felmelegszik, mielőtt a termikus egyensúly állapotába. Bizonyos körülmények között, természetesen.
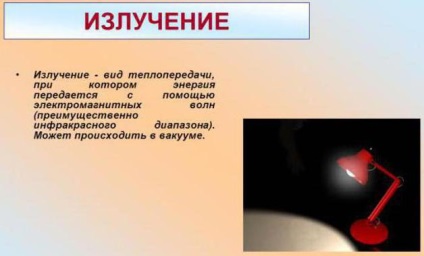
Ez a módszer elve az elektromágneses sugárzás. Ez annak köszönhető, hogy a belső energia. Erősen bemegy hősugárzás elmélet nem kezdődik, egyszerűen vegye figyelembe, hogy az ok itt az eszköz töltött részecskék, atomok és molekulák.
Egyszerű feladatok hővezető
Most beszéljünk a gyakorlatban miként néz ki, mint hőátadó számításokat. Oldjuk meg egy egyszerű probléma összefügg a hőmennyiséget. Tegyük fel, hogy van egy víztömeg egyenlő fél kilogramm. A kiindulási víz hőmérséklete - 0 Celsius fok, a végső - 100. találunk hőmennyiség töltött kapcsolati Mérés fűtés az anyag.
Ehhez van szükség a képlet Q = cm (t2 -T1), ahol Q - mennyiségű hőt, c - a fajhője a víz, m - anyag tömege, t1 - kezdeti, t2 - végső hőmérséklet. Talajvízszint az értéke c karaktert. Fajlagos hőkapacitás egyenlő 4200 J / kg * C. Most helyettesíteni ezeket az értékeket a képlet. Azt látjuk, hogy a hőmennyiség egyenlő 210000 J, illetve 210 kJ.
Az első főtétele

A termodinamika és hőátadás kapcsolódó egyes törvények. Az ezek alapján - a tudat, hogy a változás a belső energia a rendszer lehet elérni a két módszer. Eredeti - mechanikus pontozás működését. A második - egy üzenetet egy bizonyos mennyiségű hőt. Ezen elv alapján, az úton, az első főtétele. Itt látható a megfogalmazás: Ha a rendszer nem számoltak be bizonyos mennyiségű hőt, akkor fordított a bizottság munkáját külső szervek, illetve a növekmény a belső energia. A matematikai kifejezés: dQ = dU + dA.
Plusz vagy mínusz?
Abszolút minden értéket, amely része a matematikai felvételi az első főtétel felírható a „plusz” és a „mínusz” jel. A választott eljárás szabja meg a feltételeket. Tegyük fel, hogy a rendszer megkapja egy bizonyos mennyiségű hőt. Ebben az esetben a szervezet az ő hőt. Következésképpen gáz tágulási és következésképpen munkát. Ennek eredményeként, az érték pozitív lesz. Ha a hőmennyiség elvették a gázt lehűtjük, munkát rajta. Az értékek inverz értékeket.
Egy másik készítmény az első főtétele

Tegyük fel, hogy van egy batch motort. Ez munkaközeg (vagy a rendszer), végre egy ciklikus folyamat. Ezt hívják a ciklus. Ennek eredményeként, a rendszer visszatér az eredeti állapotába. Logikus lenne azt feltételezni, hogy ebben az esetben a változás belső energia egyenlő nullával. Kiderült, hogy a hőmennyiség egyenlő lesz a tökéletes munkát. Ezek a rendelkezések lehetővé teszik, hogy megfogalmazzuk a termodinamika első főtétele már más.
Ebből megérthetjük, hogy a természetben nem lehet egy örökmozgó az első ilyen. Azaz, egy eszköz, amely végez munkát egy nagyobb összeget, mint az energia kívülről érkezett. Ebben az esetben intézkedéseket kell végezni rendszeresen.
Az első főtétele az izoprotsessov
Nézzük kezdeni izochor folyamat. Alatta az állandó marad. Tehát, a hangerő változás nulla lesz. Következésképpen a munka is nulla. Mi távolítsa el ezt a komponenst a termodinamika első főtétele, majd megkapjuk a képlet dQ = dU. Ezért, izochor folyamat összes hő helyezik rendszerben megy növekvő belső energiája a gáz, vagy ezek keverékei.
Most beszéljünk izobár. Állandó marad abban uralkodó nyomást. Ebben az esetben a belső energia változik párhuzamosan bérmunkában. Itt az eredeti képlet: dQ = dU + PDV. Könnyen kiszámítható munka elvégzésére. Ez lesz egyenlő az expressziós uR (T2 -T1). By the way, ez a fizikai értelmében az egyetemes gázállandó. Jelenlétében egy mól gáz és a hőmérséklet-különbség, az egyik komponenst Kelvin, az egyetemes gázállandó egyenlő a végzett munka során izobár.
