A szerkezete és működése a nátrium-kálium ATP-áz
• Na + / K + -ATP-áz tárgya P-típusú ATP, közel a Ca2 + ATPáz és H + -ATPáz
• Na + / K + -ATP-áz Na + gradiens támaszok és a K + a plazmamembránon keresztül
• Na + / K + -ATPáz a plazmamembrán egy generátor elektromos töltés: végez három sejt Na + ion minden két K + ion, amely fecskendez be a sejtbe
• terhelhetőség Na + / K + -ATPáz-leírt séma Nagyböjt Albers, amely szerint az enzim forog a két fő konformáció
A környezetvédelemmel kapcsolatos valamennyi sejt negatív töltésű. Ez annak köszönhető, hogy a jelenléte egy kis felesleg pozitív töltésű molekulák az extracelluláris térben, és az ellenkező helyzet a citoszolban. A normális működését a sejt oldalán a plazmamembrán kell egy elektrokémiai gradiense.
Ebben a tekintetben a cella hasonlít egy elektromos akkumulátor elválasztjuk díjak, amelyeket fel lehet használni, hogy végezze el a munkát. Emlős sejtekben, a koncentráció gradienst a Na + és K + két fő összetevője a transzmembrán elektrokémiai gradiense. Belül a sejt, összehasonlítva az extracelluláris közegben, tartjuk, hogy kisebb koncentrációjú ionok Na + és a magasabb K + ionok.
A képződését és fenntartását elektrokémiai grádiens Na + ionok és K + ionok az állati sejtekben fordulnak elő érintő Na + / K + -ATP-áz, amely ion-szivattyú felhasználásával az ATP hidrolízis energiáját szállítására kationok. Segítségével ez az enzim a sejtben van beállítva negatív nyugalmi membrán potenciál, amellyel a kívánt szintet szabályozott ozmotikus nyomás, amely megakadályozza, hogy sejt-lizálják vagy csökken, és amely továbbá egy Na + -függő szállítás másodlagos molekulák.
Na + / K + kifejezés egy csoport ATPázok P-típusú, amely magában foglalja a Ca2 + ATPáz a szarkoplazmatikus retikulum amelyre egy külön cikket a honlapon (javasoljuk, hogy használja a keresőt a főoldalon az oldalon).
P-típusú ATP-áz enzimek. autofoszforilezés, amelyen egy aszparaginsav maradék az ion szállítási folyamat így egy foszforilált közbenső terméket. Során autofoszforilezés P-típusú ATP y-foszfát-csoportját ATP át az aktív hely az enzim. Minden egyes molekula hidrolizált ATP ioncserélt három Na + a citoszolba és két ion K + az extracelluláris közegbe. Na + / K + -ATP-áz működik sebességgel 100 fordulat per 1 s.
Összehasonlítva a áramlását ionok keresztül póruscsatornáinak ilyen szállítás alacsonynak tűnhet. Szállítás csatornákon keresztül történik, amelynek mértéke 107-108 ionok 1 s, m. E. Közel a diffúziós ráta ionok a vízben.
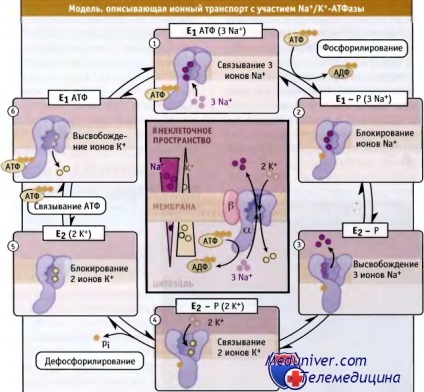
Energiájú foszfát kötés kijelölt E1-P.
Az ábra bemutatott közepén az egész ciklus az enzim.
A következő gradienseket ionok Na + és K +, míg a helyhez kötött oldalán a plazmamembrán állati sejtek.
a fő szakaszában a enzimatikus ciklus közlekedési jellemeztek ion fordul elő, hogy a részvételével Na + / K + ATP-áz. Ők képviselik a diagram of Post-Albers. Kezdetben ez a rendszer már javasolták Na + / K + -ATPáz, majd azonosítására használt specifikus állapotok egy molekula P-típusú ATP. Reakcióvázlat szerint a poszt-Albers, P-típusú ATPáz lehet, hogy két különböző konformáció, amelyek jelzik, hogy a 1 enzimet (E1) és enzim 2 (E2). Míg ezek konformációk, képesek kommunikálni, befogás és a szállítás ionok. Ezek konformációs változások bekövetkezhetnek foszforiláció-defoszforiláció reakciók:
• A konformáció intracelluláris ATP és Na + ionok nagy affinitással kötődnek a ATPáz. Ha ez az enzim át az állam E1ATF (3Na +) -függő foszforiláció bekövetkezik ATP aszparaginsav aminosav és három elkülönítési Na + ionok a konformáció E1 - P (3Na +).
• további konformációs változás eredménye állapotban E2-F, kisebb affinitást nátrium ionokat és hagyja őket az extracelluláris térben. A affinitása az enzim számára a K + ionok megnő.
• összekapcsolása ATPáz K + ionok, amelyek az extracelluláris térben vezető defoszforilációt E2-P (2K +) és, hogy rögzítse a két K + ionok egy átmenetet kijelenteni E2 (2K +).
• Ha az intracelluláris ATP-kötő konformáció változások és K + ionokat le van hasítva. Ha ez a feltétel bekövetkezik E1ATF és kötődését intracelluláris nátrium vezet konformációkat E1ATF (3Na +).
Elemzés a primer fehérjék szerkezete lehetővé teszi, hogy feltételezzük, hogy az összes P-típusú ATP-áz azonos a térbeli szerkezete és transzport mechanizmus. Na + / K + -ATPáz áll két alegységből, a katalitikus és azonos minden P-típusú ATP és szabályozó alegység, a b, amely specifikus az egyes ATPáz. Több kis alegység b rendelkezik egy transzmembrán domént, amely stabilizálja a-alegységét ATPáz és meghatározza az orientáció a membránon. A sejtek bizonyos szövetek aktivitását a Na + / K + -ATPáz, valószínűleg által szabályozott másik fehérje-alegységet y. Katalitikus alegység és kötési helyeket tartalmaz ATP, és az ion Na + és K +.
Ez az alegység izolált formában képes ion transzport, amint az a kísérletekben a heterológ expresszióhoz és elektrofiziológiai vizsgálatok.
Alegység-szerkezetet és a Na + / K + -ATPáz. alapján épült cryoelectron mikroszkóp, hasonlít a szerkezet a Ca2 + ATPáz SERCA. Mint a SERCA pumpa, alegység áll 10 transzmembránhélixek is. P-intracelluláris domén között helyezkedik transzmembrán szegmens 4. és 5., tartalmaz egy foszforilációs hely, amely rendelkezik egy közös rendszer valamennyi P-típusú ATP. Ez az oldal mutatja a jellegzetes Asp376 maradékot szekvenciája Asp-Lys-Thr-Gly-Thr-Leu-Thr. ATP-kötő és Na + ionok indukál jelentős konformációs változásokat összekapcsoló hurkokat N- és P-domének. Ezek a változások vezetnek a konvergencia az ATP kötőhely az N-domén és a foszforilációs hely a F-domén.
Na + / K + -ATP-áz egy ion szivattyú generátor. Normál fiziológiai körülmények között, a szabad energia az ATP hidrolízis (δGATF) szállításra fordított sejtekből három ionok Na + cserébe a két kálium-ionok, ahol a -ionok ellen koncentráció gradiens. Így a sejt elveszti nettó pozitív töltést. Ez hozzájárul a negatív töltés a citoplazma képest az extracelluláris közegben. Ennek eredményeként, az oldalán a sejtmembrán potenciál különbség és az ionos ozmotikus gradiens.
P-típusú ATP vannak ion szivattyúk segítségével az ATP hidrolízis energiáját fenntartani transzmembrán ion gradiens. Mivel minden egyes szakaszában a fermentációs ciklus reverzibilis, a P-típusú ATP-áz, elvileg képes ATP segítségével az energia a transzmembrán potenciál. Így, Na + / K + -ATP-áz egy bizonyos képes működni az ellenkező irányba. Ebben az esetben a Na + ionok belép a sejtbe és a K + ionok, hogy jöjjön ki, ami ahhoz a tényhez vezetnek, hogy az áramlás a ionok túlnyomórészt irányul a ketrecbe.
Közös közlekedési Na + -ionok a sejtből, és a K + ionok sejtbe történik, amíg δGATF elektrokémiai energia értéke túllépi a megfelelő ion gradiens. Amikor az energia szükséges aktív transzport Na + ionok és a K + egyenlővé válik δGATF ionok áramlási megszűnik. Ez az érték mutatja a potenciális kezelésére működő Na + / K + -ATPáz, t. E. Az érték a membránpotenciál, amely alatt az enzim kezd dolgozni az ellenkező irányba. Kezelés kapacitásának értéke a sorrendben -180 mV, t. E., Ez egy sokkal negatív érték, mint bármelyik, a sejtmembrán potenciáljának fiziológiás körülmények között. Ezért nem valószínű, hogy egy sejt beléphet az áramlás ionokat Na +, amelynek veszélyes következményei is.
De a dolgok változnak a csökkenés vérellátását. például miokardiális infarktus vagy mérgezés esetén, ami hiányzik az ATP, vagy növelni a meredeksége iongradiensváltozások. A végén, ez változást okozhat a szállítási irányában ionok Na + / K + -ATP-áz és a sejthalál.
Na + / K + -ATP-áz egy célpontja a sok toxinok és gyógyszerek. Például, növényi szteroidok úgynevezett szívglikozidok, mint például az ouabain és a digitálisz, specifikus inhibitorai ion transzport, megvalósított Na + / K + -ATPáz. Között a specifikus inhibitorok is más toxinok pl palytoxin egyes tengeri korallok és sanguinarine a növények. Ellentétben szívglikozidok, hogy gátolják az áramlás ionok keresztül a Na + / K + -ATPáz, palytoxin és szangvinarin blokk ATPáz a nyitott konfigurációban.
Így, ionok képesek kell szállítani az irányt a koncentráció gradiens, ami zavar elektrokémiai színátmenetek. Szívglikozidok reverzibilisen kötődnek helyeire Na + / K + -ATP-áz található a sejten kívül, ahol a gátolt ATP hidrolízise és ion-szállítás. Gondosan ellenőrzött gátlása Na + / K + -ATPáz miokardiális sejtek szívglikozidok, például digitálisz, használt a szívelégtelenség kezelésében. Részleges gátlást szubpopulációja Na + / K + -ATP-áz szívglikozidok enyhén növeli a sejten belüli koncentrációját ionok Na +, amelyek növekedéséhez vezet a koncentrációját Ca2 + ionok, köszönhetően szállítani keresztül a Na + / Ca2 + antiporter. Ismeretes, hogy egy kis megnövekedett intracelluláris kalciumion-koncentráció megnöveli kontraktilitás a szívizom.
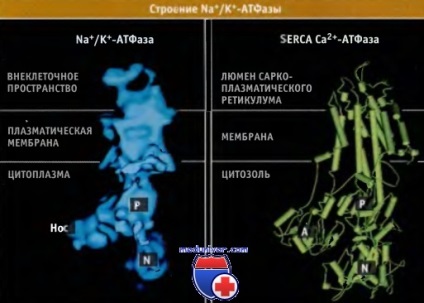
Az alegység létrehozott struktúrák alapján krio-elektronmikroszkópos vizsgálat adatait.
A fényképek SERCA konformáció kristályszerkezete E2 alapján kapott adatok Protein Data Bank fájl 1IW0.