A különböző izotópjainak egy elem egymástól
Megállapítást nyert, hogy egyes kémiai elem, amely a természetben - egy izotópok keverékét (így azok frakcionális atomi tömegeket). Ahhoz, hogy megértsük a különbség a izotópok egymástól, szükséges, hogy vizsgálja részletesen a szerkezet az atom. Atom képezi az atommag és az elektron-felhő. On atom tömege befolyásolja mozgó elektronok egy megdöbbentő sebességgel pályák a elektron felhő, neutronok és protonok alkotják a mag.
meghatározás
Izotópok - egyfajta atomok egy kémiai elem. Elektronok és a protonok az atom mindig egyenlő a számot. Mivel ezek az ellentétes töltések (elektronok - negatív, és a protonok - pozitív), mindig semleges atom (ezt az elemi részecskék nem hordoz töltést, ez nullával egyenlő a IT). A veszteség a leválasztás, vagy semleges atom veszít egy elektron, egyre akár negatív, akár pozitív ion.
A neutronok díjat, de számuk a nucleus ugyanaz az elem eltérő lehet. Ez nem befolyásolja a semlegességet az atom, de a hatás annak tömege és tulajdonságai. Például, bármely izotóp a hidrogénatom az egyik elektron és proton. A különböző számú neutront. Proto csak egy neutron deutérium - 2 neutron és trícium - 3 neutron. Ez a három izotópok jelentősen különbözik egymástól azok tulajdonságait.
Ezek különböző számú neutront, egyenlőtlen súlya és különböző tulajdonságokkal rendelkeznek. Isotopes azonos szerkezete az elektron pályák. Ez azt jelenti, hogy meglehetősen hasonló kémiai tulajdonságait. Így félre a periódusos rendszer egy helyen.
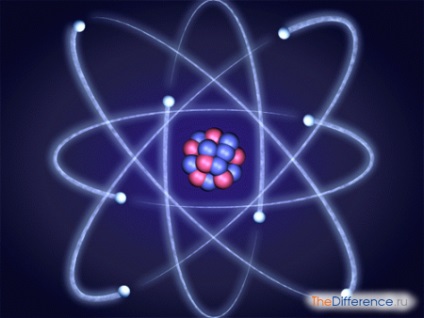
A természetben található és a radioaktív izotópok stabil (instabil). Cores radioaktív izotópok atomok képesek spontán módon átalakíthatjuk más mag. Során radioaktív bomlás, bocsátanak ki a különböző részecskék.
Létezik a izotópok lehetővé annak megértését, hogy miért, bizonyos esetekben elemei kisebb tömegszámú nagyobb sorszámmal, mint az elemek nagyobb atomtömeg. Például, párosított kálium argon-argon tartozik a nehéz izotópok, és kálium - könnyű izotópok. Ezért, a súlya argon nagyobb, mint a kálium.
következtetések TheDifference.ru
- Ezek különböző számú neutront.
- Az izotópok olyan atomok különböző tömegű.
- A tömege atomi ionok befolyásolja a teljes energia és tulajdonságait.