A elektromotoros erő (EMF) a cella
Az ok az elektromos áram a sejtben a különbség az elektród potenciál a két redox rendszerek. Ezt a különbséget jelöli? E és nevezett elektromotoros erő (EMF) a cella. Mivel a EMF - pozitív érték, azt találtuk, mint a különbség a magas (katód) és egy alsó elektródát (anód) potenciálok értékek:
Táblázat szabványos redoxpotenciálok
Leggyakrabban az ilyen fél-reakció talpra táblázatok nem a sorrendben növekvő értékei E o. és csoportosítva alapján azok tartalmát az egyes elemek, például nitrogén, mangán, króm, stb Kérjük, vegye figyelembe az alábbiakat. A táblázat szerint a IUPAC, mind fél reakció írva helyreállítási folyamatokban. Bár bármely félévben reakciót OVR hasznosítás mindig kombinálva egy fél-reakció oxidációs. Ne feledje, hogy a két fél-reakció helyreállítási balról jobbra mindig félig reakció fordul elő nagyobb értékű E o. A másik fele reakciót egy kisebb e értéke mindig folyik a fordított irányú, és valójában egy fél-reakció oxidációs. Ezért, a készítmény félig-reakció egyenletek OVR egy kisebb érték E kell „turn” a fél-reakció oxidációs. Ebből a célból az érintett egyenlet szükséges cserélni oxidált és redukált formája, így az elektronok a bal oldalon, de a szám előtt változtatni jel „plusz” és „mínusz”. Megjegyezzük, hogy a jele az elektród potenciál nem változik!
Értékének felhasználásával az elektróda vagy redox fele reakciót potenciálok, lehetőség van a következő műveletek elvégzése:
1. Rate redox tulajdonságait anyagok.
Több több anyagot silnymivosstanovitelnymi tulajdonságokkal rendelkezik az anyag, amely megfelel a fél-reakció alacsonyabb értéke a lehetséges. Fordítva, több silnymiokislitelnymi tulajdonságai van az anyag, amely megfelel a fél-reakció magasabb potenciális értékét.
2. Megjósolni az alapvető lehetőségét reakció
A haladás, a redox reakció ebben az irányban csak akkor lehetséges, ha a lehetséges a fele reakciót, a használt oxidálószer nagyobb, mint a lehetséges fele reakciót, a használt redukálószer.
3. Határozza meg az irányt a reakció.
Bármilyen OVR mindig folyik az irányban, amelyben a fele reakciót magasabb potenciális értékét. Ez az irány megfelel a pozitív érték EMF reakciót. Azonban nem szabad elfelejtenünk, hogy ebben az irányban a reakció gyakorlatilag visszafordíthatatlan alatt EMF nagyobb vagy egyenlő, mint 0,4V. Ha a potenciális különbség kisebb, mint 0,4 V, az IAD és a reakció reverzibilis által meghatározott irányban feltételeit annak végrehajtását.
4. Válassza ki a legvalószínűbb lehetőség, több reakció-CIÓ.
Az összes lehetséges WRA nagy valószínűséggel lesz a válasz, ami megfelel a maximális értéket (EMF).
3. redoxifolyamatainak érintő elektromos áram. Elektrolízis megolvad, és vizes oldatok az elektrolitok. Elektrolízis Inert és aktív elektródok. az elektród folyamat diagramok. Előállítása A szervetlen anyagok és azok tisztítással az elektromos áram. Kémiai forrásokból.
E
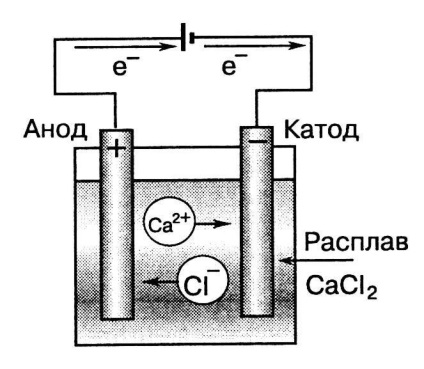
Az elektrolízis a villamos áram energia alakul kémiai energiává, és ahol az eljárást úgy hajtjuk végre, a fordított történik a sejtben.
Reakcióvázlat olvadék elektrolízise kalcium-klorid
Közönségmegtartási diagram, megjegyzés, hogy a díjak az elektródák elektrolízis során elektród ellenkező töltésű a sejtben. ezért:
Katód - negatív töltésű elektród csatlakozik a negatív pólus áramforrás. A katód az elektrolízis egy redukálószer. Meg felszínén katódos redukciós folyamatok fordulnak elő. A katód mindig készült inert anyagok (grafit, platina, arany, irídium, stb).
Az anód pozitív töltésű elektród, amely elektrolízissel oxidálószer. Felületén mindig fordul elő anódos oxidációs folyamatokat. Az anód lehet gyártani, mint inert anyagot ( „inert” vagy „oldhatatlan” anód), és a fém, amely képes az elektrolízis során menetben oldatba ( „oldható anód”).
Az áthaladó elektromos áram segítségével az elektrolit oldat vagy olvadék ionokat tartalmazott tart irányuló mozgás: pozitív töltésű kationokat kerülnek a negatív töltésű katód és a negatív töltésű anionok - a pozitív töltésű katód (6. ábra).
Eljárások a katódon.
Az olvadt elektrolitot a katód helyreáll mindig fémkationok séma szerint: Férfiak ++ vio- = Me0.
A vizes oldatok az elektrolitok a természet a katód folyamatok azt természete határozza meg a kationok:
g) kationok [Mn 2+ - Pb 2+]: egyszerre visszanyert fémkationok és a vízmolekulák.
Folyamatok által az inert anód.